本试题 “红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。根据上图回答下列问题:(1)P和Cl2反应生成...” 主要考查您对单质磷及其化合物
热化学方程式
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质磷及其化合物
- 热化学方程式
- 化学反应热的计算
磷在自然界中的存在:
自然界中没有游离态的磷,磷主要以磷酸盐的形式存在于矿石中。磷和氮一样,是构成蛋白质的成分之一。动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷,磷对维持生物体正常的生理机能起着重要的作用。
磷的物理性质:
磷的单质有多种同素异形体,其中常见的是白磷和红磷。白磷和红磷的主要性质如下表。 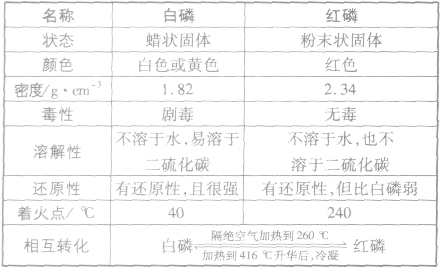
特别提醒白磷遇光会逐渐变为黄色。因此,白磷又称黄磷,白磷的颜色往往表述为“白色或黄色”。
白磷和红磷的化学性质:
白磷和红磷都能在空气或氧气中燃烧,燃烧产物一般是五氧化二磷,且反应放出大量的热,4P+5O2 2P2O5
2P2O5
磷的用途:
白磷和红磷有许多用途,如都可用于制造纯度较高的磷酸;白磷可用于制造燃烧弹、烟幕弹等;红磷可用于制农药、安全火柴等。
白磷和红磷的分子结构:
白磷的分子组成为P4,分子的空间构型为正四面体(如图A)。红磷的结构较复杂,有人认为红磷是P4分子断裂一个键后相互结合形成的长链状分子(如图B).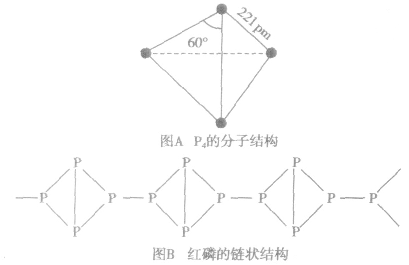
特别提醒白磷和红磷的化学式通常都写为P。
磷的化合物:
(1)五氧化二磷:
五氧化二磷的分子式为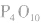 ,通常写为
,通常写为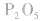 ,
,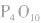 分子的空间构型如图所示。
分子的空间构型如图所示。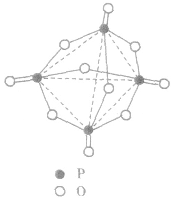
五氧化二磷通常为白色固体,由磷在空气中燃烧生成, 632K时升华。
五氧化二磷是典型的酸性氧化物,具有酸性氧化物的通性。
五氧化二磷很易跟水反应,跟冷水反应生成偏磷酸,跟热水反应生成磷酸,反应放出大量的热。 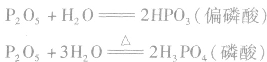
五氧化二磷的强亲水性决定了它可用作干燥剂。五氧化二磷是一种固态、酸性、无强氧化性的干燥剂,干燥能力非常强。
(2)磷酸:
磷酸为三元中强酸,属于弱电解质,易溶于水,在水中分三级电离。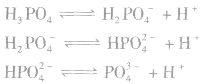
纯磷酸是无色晶体,熔点为315K.沸点较高,可溶于水。
磷酸无强氧化性,具有酸的通性。为了避免Br-、 I-被氧化,可用浓磷酸代替浓硫酸在实验室中制备HBr和HI。
(3)磷酸盐:
磷酸是三元酸,对应的盐有正盐和酸式盐: 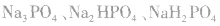 .
.
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
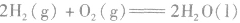 :
: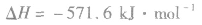 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
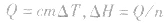
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
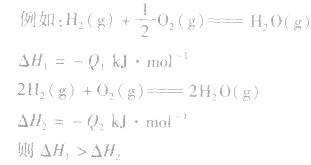
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
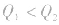 .
.与“红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和...”考查相似的试题有:
- 三氯化氮分子中每个原子其最外层均达到8电子稳定结构,下列关于三氯化氮的叙述正确的是( )A.NCl3的电子式应表示为B.在NCl...
- 在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物...
- 要制取H2、O2、Cl2、HCl、NH3、H2S,从下列各物质中,分别选出必要的物质,将序号填在括号内。a.硫化亚铁 b.浓硫酸 c.浓盐酸 ...
- 下列过程属于固氮的是A.NH3→NOB.NO→NO2C.NH3→NH4NO3D.N2→NH3
- 在8NH3+3Cl2====6NH4Cl+N2反应中,若有2 mol N2生成,发生氧化反应的物质的量是( )A.16 mol NH3 B...
- 已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol,②稀溶液中, H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol,...
- 下列说法正确的是( ) A.中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 B.已知...
- 一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为( ) A.H2(g)+1/2O2(g)═H2O(g)△H...
- A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形...
- 直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸...