本试题 “氧气、二氧化碳、过氧化氢和一氧化碳是初中化学中常见的物质,如图是它们的部分应用.这些物质中:(1)可作制冷剂,用于人工降雨的物质是(填物质名称或化学...” 主要考查您对化学式的写法和意义
一氧化碳的性质和用途
二氧化碳的用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学式的写法和意义
- 一氧化碳的性质和用途
- 二氧化碳的用途
概念:
用元素符号和数字的组合表示物质组成的式子,叫做化学式。如可用O2,H2O,MgO分别表示氧气、水、氧化镁的化学式。
对概念的理解:
(1)混合物不能用化学式表示,只有纯净物才能用化学式表示。
(2)每一种纯净物只有一个化学式,但一个化学式有可能用来表示不同的物质。如氧气的化学式是O2,没有别的式子再能表示氧气;P既是红磷的化学式,也是白磷的化学式。
(3)纯净物的化学式不能臆造,化学式可通过以下途径确定:
①科学家通过进行精确的定量实验,测定纯净物中各元素的质量比,再经计算得出。
②已经确定存在的物质可根据化合价写出。
书写规则:
1.单质化学式的写法:
首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2.化合物化学式的写法:
首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
化学式的读法:
一般是从右向左叫做“某化某”,如“CuO”叫氧化铜。当一个分子中原子个数不止一个时,还要指出一个分子里元素的原子个数,如“P2O5”叫五氧化二磷。有带酸的原子团要读成“某酸某”如“CuSO4”叫硫酸铜,还有的要读“氢氧化某”,如“NaOH”叫氢氧化钠。“氢氧化某”是碱类物质,电离出来的负电荷只有氢氧根离子。
化学式的意义:
(1)由分子构成的物质
(2)由原子构成的物质(以Cu为例)
宏观:
表示该物质:铜
表示该物质由什么元素组成:铜由铜元素组成
微观:表示该物质的一个原子—一个铜原子。
②交叉法
确定化学式的几种方法:
1. 根据化合价规则确定化学式
例1:若A元素的化合价为+m,B元素的化合价为-n,已知m与n都为质数,求A,B两元素化合后的物质的化学式。
解析:由题意知正、负化合价的最小公倍数为m ·n,A的原子个数为(m·n)/m=n,B的原子个数为 (m·n)/n=m
答案:所求化学式为AnBm.
2. 根据质量守恒定律确定化学式
例2:根据反应方程式2XY+Y2==2Z,确定Z 的化学式
解析:根据质量守恒定律,反应前后原子种类不变,原子数目没有增减,反应前有两个X原子,四个Y原子,则两个Z分子含有两个X原子和四个Y原子。
答案:z的化学式为XY2
3. 利用原子结构特征确定化学式
例3:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,求X、Y两元素所形成的化合物的化学式。
解析:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,X原子易得1个电子,Y原子易失2个电子,根据电子得失相等可求化合物的化学式为YX2
4.利用元素质量比确定化学式:
例4:有一氮的氧化物,氮、氧两元素的质量比为7: 4,求此氧化物的化学式。
解析:设此氧化物的化学式为NxOy,根据xN:yO =7:4 得14x:16y=7:4,即x:y=2:1。
答案:所求氧化物的化学式为N2O。
5. 利用化学式中所含原子数、电子数确定化学式
例5:某氮氧化合物分子中含有3个原子,23个电子,求此化合物的化学式。
解析:设此化合物的化学式为NxOy,则
x+y=3
7x+8y=23
解得x=1,y=2
答案:所求化学式NO2。
利用化学式的变形比较元素的原子个数:
例:质量相等的SO2和SO3分子中,所含氧原子的个数比为?
解析:SO2的相对分子质量为64,SO3的相对分子质量为80,二者的最小公倍数是320,二者相对分子质量相等时物质的质量相同,转化为分子个数SO2 为320/64=5,SO3为320/80=4,即5SO2与4SO3质量相同,所以含氧原子的个数比为(5×2):(4×3)=10:12=5:6。
四、利用守恒法进行化学式计算:
例:由Na2S、Na2SO3、Na2SO4三种物质构成的混合物中,硫元素的质量分数为32%,则混合物中氧元素的质量分数为?
解析:在Na2S,Na2SO3,Na2SO4中,钠原子与硫原子的个数比是恒定的,都是2:1,因而混合物中钠、硫元素的质量比(或质量分数比)也是恒定的。设混合物中钠元素的质量分数为x,可建立如下关系式。
Na ——S
46 32
x 32%
46/32=x/32%
解得x=46%
混合物中氧元素的质量分数为1-32%-46%=22%。
利用平均值法判断混合物的组成
找出混合物中各组分的平均值(包括平均相对原子质量、平均相对分子质量、平均质量、平均质量分数等),再根据数学上的平均值原理,此平均值总是介于组成中对应值的最大值与最小值之间,由此对混合物的组分进行推理判断。
例:某气休可能由初中化学中常见的一种或多种气体组成,经测定其中只含C,O两种元素,其质量比为3:8,则该气体可能是?
解析:由题给条件知,该气体只含C,O两种元素,而这两种元素组成的气体可能是CO2、CO,O2。CO2中C,O两种元素的质量比是3:8,CO中C,O两种元素的质量比是3:4,O2中C,O两种元素的质量比是0 (因C的质量为0)。题中给出该气体中C,O两种元素的质量比是3:8,故符合题意的气体组成为:CO2或 CO,O2或CO,O2,CO2。
利用关系式法解题技巧:
关系式法是根据化学式所包含的各种比例关系,找出已知量之间的比例关系,直接列比例式进行计算的方法。
例: 多少克(NH4)2SO4与42.4g尿素CO(NH2)2所含的氮元素质量相等?
设与42.4g尿素中所含氮元素质量相等的(NH4)2SO4的质量为x
(NH4)2SO4——2N——CO(NH2)2
132 60
x 42.4g
132/x=60/42.4g
x=93.28
化学式前和化学式中数字的含义:
①化学式前面的数字表示粒子(原子、分子)数目;
②离子符号前的数字表示离子的数目;
③化学式石一下角的数字表示该粒子中对应原子或原子团的数目;
④离子符号右上角的数字表示该离子所带电荷数。

用元素符号和数字的组合表示物质组成的式子,叫做化学式。如可用O2,H2O,MgO分别表示氧气、水、氧化镁的化学式。
对概念的理解:
(1)混合物不能用化学式表示,只有纯净物才能用化学式表示。
(2)每一种纯净物只有一个化学式,但一个化学式有可能用来表示不同的物质。如氧气的化学式是O2,没有别的式子再能表示氧气;P既是红磷的化学式,也是白磷的化学式。
(3)纯净物的化学式不能臆造,化学式可通过以下途径确定:
①科学家通过进行精确的定量实验,测定纯净物中各元素的质量比,再经计算得出。
②已经确定存在的物质可根据化合价写出。
书写规则:
1.单质化学式的写法:
首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2.化合物化学式的写法:
首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
化学式的读法:
一般是从右向左叫做“某化某”,如“CuO”叫氧化铜。当一个分子中原子个数不止一个时,还要指出一个分子里元素的原子个数,如“P2O5”叫五氧化二磷。有带酸的原子团要读成“某酸某”如“CuSO4”叫硫酸铜,还有的要读“氢氧化某”,如“NaOH”叫氢氧化钠。“氢氧化某”是碱类物质,电离出来的负电荷只有氢氧根离子。
化学式的意义:
(1)由分子构成的物质
| 化学式的含义 | 以H2O为例 | ||
| 质的含义 | 宏观 | ①表示一种物质 ②表示物质的元素组成 |
①表示水 ②表示水是由氢、氧两种元素组成的 |
| 微观 | ①表示物质的一个分子 ②表示组成物质每个分子的原子种类和数目 ③表示物质的一个分子中的原子总数 |
①表示一个水分子 ②表示一个水分子是由两个氧原子和一个氧原子构成的 ③表示一个水分子中含有三个原子 | |
| 量的含义 | ①表示物质的相对分子质量 ②表示组成物质的各元素的质量比 ③表示物质中各元素的质量分数 |
①H2O的相对分子质R =18 ②H2O中氢元素和氧元素质量比为1:8 ③H2O中氢元素的质量分数= 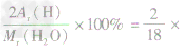 100%=11.1% 100%=11.1% | |
(2)由原子构成的物质(以Cu为例)
宏观:
表示该物质:铜
表示该物质由什么元素组成:铜由铜元素组成
微观:表示该物质的一个原子—一个铜原子。
化学式和化合价的关系:
(1)根据化学式求化合价
①已知物质的化学式,根据化合价中各元素的正负化合价代数和为0的原则确定元素的化合价。
标出已知、未知化合价: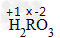
列出式子求解:(+1)×2+x×1+(-2)×3=0 x=+4
②根据化合价原则,判断化学式的正误,如判断化学式KCO3是否正确
标出元素或原子团的化合价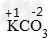
计算正负化合价代数和是否为0:(+1)×1+(-2)×1=-1≠0,所以给出的化学式是错误的,正确的为K2CO3。
③根据化合价原则,计算原子团中某元素的化合价,如计算NH4+中氮元素的化合价和H2PO4-(磷酸二氢根)中磷元素的化合价。
由于NH4+带一个单位的正电荷,不是电中性的,因此各元素的化合价代数和不为多,而是等于+1. 设氮元素的化合价为x
x+(+1)×4=+1 x=-3
所以在NH4+中,氮元素的化合价为-3. 同理H2PO4-带一个单位的负电荷、不是电中性的、因此各元素的化合价代数和不为零,而是-1.
设磷元素的化合价为y
(+1)×2+y+(-2)×4=-1 y=+5 所以在H2PO4-中磷元素的化合价为+5.
④根据化合价原则,确定物质按化合价的排序。如H2S,S,SO2,H2SO4四种物质中均含有硫元素,并且硫元素的化合价在四种物质中分别为:-2,0, +4,+6,故这四种物质是按硫元素的化合价由低到高的顺序排列的。
(2)根据化合价写化学式
根据化合物中化合价的代数和等于0的原则,已知元素的化合价可以推求实际存在物质的化学式,主要方法有两种:
①最小公倍数法
| 步骤 | 举例 | |
| 写 | 一般把正价元素的符号(或原子团)写在左边,负价元素的符号(或原子团)写在右边,并把化合价写在元素符号(或原子团)的正上方 | 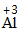 、 、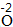 |
| 求 | 求出两种元素化合价绝对位的最小公倍数,然后求出每种元素的原子个数= |
因为|-2|×|+3|=6,所以Al原子个数为6/3=2,O原子个数=6/2=3 |
| 标 | 将原子个数写在相应元素符号的正下角 | Al2O3 |
| 验 | 检验各种元素正负化合价的代数和是否为0,确定化学式的正确性 | (+3)×2+(-2)×3=0,所以该化学式正确。 |
| 步骤 | 例1 硫酸铜 | 例2 氧化钙 | |
| 排列 | 分析名称,确定元素符号(或原子团)的顺序 | 铝 硫酸根 Al SO4 |
钙 氧 Ca O |
| 标价 | 标上化合价 | 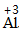 、 、 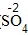 |
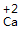 、 、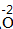 |
| 约简 | 将化合价的绝对值约成最简整数比 |  、 、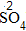 |
 、 、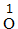 |
| 交叉 | 将整数交叉写在元素符号(或原子团)的右下角 |  |
 |
| 检验 | 根据正负化合价代数和是否为0,检验正误 | (+3)×2+(-2)×3=0 | (+2)+(-2)=0 |
确定化学式的几种方法:
1. 根据化合价规则确定化学式
例1:若A元素的化合价为+m,B元素的化合价为-n,已知m与n都为质数,求A,B两元素化合后的物质的化学式。
解析:由题意知正、负化合价的最小公倍数为m ·n,A的原子个数为(m·n)/m=n,B的原子个数为 (m·n)/n=m
答案:所求化学式为AnBm.
2. 根据质量守恒定律确定化学式
例2:根据反应方程式2XY+Y2==2Z,确定Z 的化学式
解析:根据质量守恒定律,反应前后原子种类不变,原子数目没有增减,反应前有两个X原子,四个Y原子,则两个Z分子含有两个X原子和四个Y原子。
答案:z的化学式为XY2
3. 利用原子结构特征确定化学式
例3:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,求X、Y两元素所形成的化合物的化学式。
解析:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,X原子易得1个电子,Y原子易失2个电子,根据电子得失相等可求化合物的化学式为YX2
4.利用元素质量比确定化学式:
例4:有一氮的氧化物,氮、氧两元素的质量比为7: 4,求此氧化物的化学式。
解析:设此氧化物的化学式为NxOy,根据xN:yO =7:4 得14x:16y=7:4,即x:y=2:1。
答案:所求氧化物的化学式为N2O。
5. 利用化学式中所含原子数、电子数确定化学式
例5:某氮氧化合物分子中含有3个原子,23个电子,求此化合物的化学式。
解析:设此化合物的化学式为NxOy,则
x+y=3
7x+8y=23
解得x=1,y=2
答案:所求化学式NO2。
利用化学式的变形比较元素的原子个数:
例:质量相等的SO2和SO3分子中,所含氧原子的个数比为?
解析:SO2的相对分子质量为64,SO3的相对分子质量为80,二者的最小公倍数是320,二者相对分子质量相等时物质的质量相同,转化为分子个数SO2 为320/64=5,SO3为320/80=4,即5SO2与4SO3质量相同,所以含氧原子的个数比为(5×2):(4×3)=10:12=5:6。
四、利用守恒法进行化学式计算:
例:由Na2S、Na2SO3、Na2SO4三种物质构成的混合物中,硫元素的质量分数为32%,则混合物中氧元素的质量分数为?
解析:在Na2S,Na2SO3,Na2SO4中,钠原子与硫原子的个数比是恒定的,都是2:1,因而混合物中钠、硫元素的质量比(或质量分数比)也是恒定的。设混合物中钠元素的质量分数为x,可建立如下关系式。
Na ——S
46 32
x 32%
46/32=x/32%
解得x=46%
混合物中氧元素的质量分数为1-32%-46%=22%。
利用平均值法判断混合物的组成
找出混合物中各组分的平均值(包括平均相对原子质量、平均相对分子质量、平均质量、平均质量分数等),再根据数学上的平均值原理,此平均值总是介于组成中对应值的最大值与最小值之间,由此对混合物的组分进行推理判断。
例:某气休可能由初中化学中常见的一种或多种气体组成,经测定其中只含C,O两种元素,其质量比为3:8,则该气体可能是?
解析:由题给条件知,该气体只含C,O两种元素,而这两种元素组成的气体可能是CO2、CO,O2。CO2中C,O两种元素的质量比是3:8,CO中C,O两种元素的质量比是3:4,O2中C,O两种元素的质量比是0 (因C的质量为0)。题中给出该气体中C,O两种元素的质量比是3:8,故符合题意的气体组成为:CO2或 CO,O2或CO,O2,CO2。
利用关系式法解题技巧:
关系式法是根据化学式所包含的各种比例关系,找出已知量之间的比例关系,直接列比例式进行计算的方法。
例: 多少克(NH4)2SO4与42.4g尿素CO(NH2)2所含的氮元素质量相等?
设与42.4g尿素中所含氮元素质量相等的(NH4)2SO4的质量为x
(NH4)2SO4——2N——CO(NH2)2
132 60
x 42.4g
132/x=60/42.4g
x=93.28
化学式前和化学式中数字的含义:
①化学式前面的数字表示粒子(原子、分子)数目;
②离子符号前的数字表示离子的数目;
③化学式石一下角的数字表示该粒子中对应原子或原子团的数目;
④离子符号右上角的数字表示该离子所带电荷数。

概述:
一氧化碳(CO)纯品为无色、无臭、无刺激性的气体。分子量28.01,密度1.250g/l,冰点为-207℃,沸点-190℃。在水中的溶解度甚低。空气混合爆炸极限为12.5%~74%。一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。因此一氧化碳具有毒性。一氧化碳是无色、无臭、无味的气体,故易于忽略而致中毒。常见于家庭居室通风差的情况下,煤炉产生的煤气或液化气管道漏气或工业生产煤气以及矿井中的一氧化碳吸入而致中毒。
物理性质:
通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
化学性质:
(1)可燃性:2CO + O2 2CO2
2CO2
(2)还原性:
一氧化碳还原氧化铜:CO+ CuO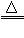 Cu + CO2
Cu + CO2
一氧化碳还原氧化铁:3CO+ Fe2O3 2Fe + 3CO2
2Fe + 3CO2
一氧化碳还原四氧化三铁:4CO+ Fe3O4 3Fe + 4CO2
3Fe + 4CO2
(3)毒性:
CO极易和血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时危及生命。CO有剧毒,人在CO的体积分数达到 0.02%的空气中持续停留2—3h即出现中毒症状,因此我们使用煤、燃气热水器时要装烟囱,注意室内通风。
用途:
用作燃料,冶炼金属。
一氧化碳和氢气的比较
H2、CO、C的比较
注意:
(1)三种物质燃烧的现象有所不同,但不能根据火焰去鉴别CO和H2
(2)在还原CuO的实验中,必须对多余的CO进行处理
一氧化碳(CO)纯品为无色、无臭、无刺激性的气体。分子量28.01,密度1.250g/l,冰点为-207℃,沸点-190℃。在水中的溶解度甚低。空气混合爆炸极限为12.5%~74%。一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。因此一氧化碳具有毒性。一氧化碳是无色、无臭、无味的气体,故易于忽略而致中毒。常见于家庭居室通风差的情况下,煤炉产生的煤气或液化气管道漏气或工业生产煤气以及矿井中的一氧化碳吸入而致中毒。
物理性质:
通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
化学性质:
(1)可燃性:2CO + O2
 2CO2
2CO2 (2)还原性:
一氧化碳还原氧化铜:CO+ CuO
 Cu + CO2
Cu + CO2 一氧化碳还原氧化铁:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 一氧化碳还原四氧化三铁:4CO+ Fe3O4
 3Fe + 4CO2
3Fe + 4CO2 (3)毒性:
CO极易和血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时危及生命。CO有剧毒,人在CO的体积分数达到 0.02%的空气中持续停留2—3h即出现中毒症状,因此我们使用煤、燃气热水器时要装烟囱,注意室内通风。
用途:
用作燃料,冶炼金属。
一氧化碳和氢气的比较
| 颜色状态 | 无色,无味气体 | 无色,无味气体 |
| 密度 | 1.250g/l(略小于空气) | 0.089g/l(最轻的气体) |
| 可燃性 | 有可燃性 2CO+O2  2CO2 2CO2 |
有可燃性 2H2+O2  2H2O 2H2O |
| 还原性 | 有还原性 CO+CuO  Cu+CO2 Cu+CO2 |
有还原性 H2+CuO  Cu+H2O Cu+H2O |
| 毒性 | 剧毒 | 无毒 |
| 鉴别方法 | 根据燃烧产物的不同鉴别 | |
H2、CO、C的比较
| H2 | C | CO | ||
| 可燃性 | 化学方程式 | 2H2+O2 2H2O 2H2O |
C+O2 CO2; CO2;2C+O2  2CO 2CO |
2CO+O2 2CO2 2CO2 |
| 反应现象 | 淡蓝色火焰,放热,生成 无色液体 |
发光,放热 | 蓝色火焰,放热, 生成的无色气体 能使澄清石灰水 变浑浊 | |
| 还原性 | 方程式 |  |
 |
 |
| 反应现象 | 黑色固体变红,生成无色液体,管口有水珠 | 黑色固体变红,生成的无色气体能使澄清石灰水变洪浑浊 | 黑色固体变红,生成的无色气体能使澄清石灰水变浑浊 | |
| 装置图 |  |
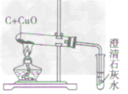 |
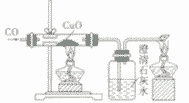 | |
| 装置要点 | 试管口略向下倾斜,导管贴试管上臂至药品上方,试管口没有橡皮塞 | 试管口略向下倾斜,导管刚过橡皮塞 | 多余的CO要进行尾气处理(如点燃) | |
| 主要步骤 | 通H2→加热→停止加热→停止通H2 | 反应结束后,先将导管从液体中取出,再停止加热 | 通CO→加热→停止加热→停止通CO | |
| 优点 | 反应条件低,生成物是水,不污染环境 | 原料便宜,操作简便 | 反应条件低 | |
| 缺点 | 不安全,操作复杂 | 反应条件高,生成物不易提纯 | 不安全,操作复杂,有毒 | |
| 用途 | 作工业原料,作高能燃料,冶炼金属 | 作燃料,冶炼金属, | 作燃料,冶炼金属, | |
(1)三种物质燃烧的现象有所不同,但不能根据火焰去鉴别CO和H2
(2)在还原CuO的实验中,必须对多余的CO进行处理
二氧化碳用途:
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
发现相似题
与“氧气、二氧化碳、过氧化氢和一氧化碳是初中化学中常见的物质...”考查相似的试题有:
- 有A、B、C、D四种元素,已知A是地壳中含量最多的元素,B元素的原子失去一个电子后只剩下一个质子,C元素是海水中含量最高的金...
- 有A,B,R三种元素,在空气中A元素的单质约占总体积的21%,B元素与A元素组成的氧化物在通常情况下为无色无味的液体,R元素的...
- 请从H、He、O、C、Cl、Na、Ca等几种元素中选择适当元素,按要求填空:(1)写出下列粒子符号.①2个氯原子______;②3个氢氧根...
- 从H、C、O、S、Ca五种元素中选择适当的元素组成符合下列要求的物质,并将化学式填入空格中:(1)可作建筑材料的盐______,(...
- 我国西部资源丰富.目前我国实施的“西气东输”工程,输送的是一种当今世界最重要的气体矿物燃料,其化学式为( )A.COB.H2C...
- 下列化学式书写错误的是( )A.氧化铝A12O3B.氢氧化钾KOHC.氯化钙CaClD.硝酸HNO3
- 人类发明并使用氟利昂(主要用作制冷剂)若干年后,科学家发现氟利昂进入大气层后,在紫外线照射下,分解出氯原子能消耗臭氧...
- (1)在C、H、O、S、Cu五种元素中,选择适当元素,组成符合下列要求的物质,请将其化学式填入空格中.①天然气的主要成分_____...
- 测定食品的蛋白质含量,常通过测定氮元素的含量来间接推算食品中蛋白质的含量.三鹿奶粉事件的发生,就是一些不法分子为了使...
- 下图中A是一种显示事物异同点的信息处理方法,两个圆分别代表金刚石和石墨的有关信息,两圆重叠的区域表示金刚石和石墨的共同...