本试题 “下列的叙述正确的是[ ]A.甲烷分子中由于C原子发生了sp3轨道杂化而形成正四面体的立体结构B.甲醛分子中的化学键都是σ键C.二氧化碳分子呈直线形结构是因为C...” 主要考查您对杂化轨道理论(中心原子杂化方式)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
杂化轨道理论:
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
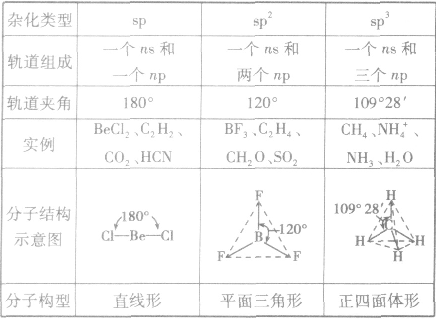
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
发现相似题
与“下列的叙述正确的是[ ]A.甲烷分子中由于C原子发生了sp3轨道...”考查相似的试题有:
- A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原...
- [化学-物质结构与性质]金属镍在电池、合金、催化剂等方面应用广泛.(1)下列关于金属及金属键的说法正确的是______.a.金属...
- [化学-物质结构与性质]氨和水都是常用的试剂.请回答下列问题:(1)氮元素基态原子的核外电子中,未成对电子数与成对电子数...
- 【三选一—物质结构与性质】碳元素是构成有机物的基础元素。(1)写出碳元素核外电子排布式_____________。(2)甲烷与水分子...
- 下表为长式周期表的一部分,其中的编号代表对应的元素。(1)写出上表中元素⑨原子基态时的电子排布式________,该元素的符号是_...
- 化学--选修物质结构与性质下面是C60、金刚石和二氧化碳的分子模型.请回答下列问题:(1)硅与碳同主族,写出硅原子基态时的...
- (1)在元素周期表中,同一主族元素化学性质相似,目前也发现有些元素的化学性质和它在元素周期表中左上方或右下方的另一主族元...
- 下列说法中错误的是[ ]A.当中心原子的配位数为6时,配合单元常呈八面体空间结构B.[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp...
- 根据杂化理论回答下列问题。(1)上表中各物质中心原子是否以杂化轨道成键?以何种类型杂化轨道成键?________________________...
- C和Si元素在化学中占有极其重要的地位。(1)写出Si的基态原子核外电子排布式______________。从电负性角度分析,C、Si和O元素...