本试题 “(15分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为 mol/L。(2)取用任意体积的该盐酸溶液时,...” 主要考查您对物质的量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量
物质的量:
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
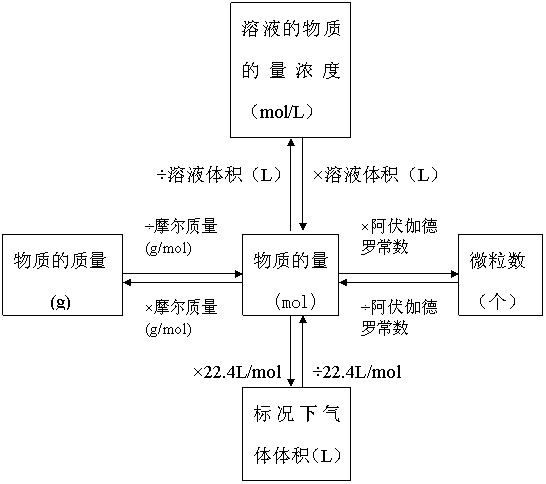
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
使用物质的量注意事项:
(1)物质的量表示物质所含指定粒子的多少,物质的量是一个整体,不得简化或增添任何字。
(2)物质的量及其单位摩尔的适用范围是微观粒子,因此在使用中应指明粒子的名称。
物质的量的相关解法:
问题探究:
(1)1mol氢这种说法正确吗?如何表示1mol氢原子、1mol氢分子、1mol氢离子?
答:使用摩尔作单位时,应用化学式(符号)指明离子的种类,1mol氢的说法不正确,因其咩有指明是氢分子还是氢离子、氢原子。1mol氢原子、1mol氢分子、1mol氢离子分别表示为1molH、1molH2、1molH+。
(2)阿佛加德罗常数和6.02×1023mol-1在实际使用上有何区别?
阿佛加德罗常数是一个非常精确的数字,而6.02×1023mol-1只是阿佛加德罗常数的一个近似值。在关于概念性描述时要求非常准确,要使用阿佛加德罗常数,而在涉及计算时,则用6.02×1023mol-1进行粗略计算。二者关系类似于数学上的圆周率∏与3.14的关系。
发现相似题
与“(15分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数...”考查相似的试题有:
- 把金属钠2.3g溶于水中,要使所得溶液中,钠离子与水分子个数之比为1:100,则所需要水的质量是 ( )A.181.8gB.180gC.181...
- 下列说法中正确的是A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/LB.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,...
- 设NA为阿伏加德罗常数的值,下列叙述正确的是A.1mol氯气参加氧化还原反应,转移的电子数一定为2NAB.25℃时,1 L pH=12的Na2C...
- 下表列出了四种溶液溶质的质量分数和物质的量浓度数值:溶质HClHNO3CH3COOHNaOH溶质的质量分数/%36.5634040物质的量浓度/mol·...
- 阿伏伽德罗常数约为6.02×1023mol-1,下列叙述中正确的是A.将含有NO2和N2O4分子数共约6.02×1023个的混合气体温度降至标准状况...
- 气体体积的大小,跟下列因素几乎无关的是A.分子个数B.温度C.压强D.分子直径
- 石墨由多“层”构成,质地柔软,但分离成一“层”后即成为“石墨烯”,硬度超过了金刚石,导电能力也大大超过了一般的导体,这再次...
- 取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的...
- 设NA为阿伏加德罗常数的值。下列叙述正确的是 ( )。A.25 ℃,1 L pH=1的稀硫酸中含有的H+数为0.1 NAB.标准状况下,224 mL...
- .用NA表示阿伏加德罗常数的值。下列叙述正确的是A.将1mol铁粉加入到一定量的稀硝酸溶液中充分反应,转移的电子数一定是3NAB...