本试题 “下列现象的描述正确的是( )A.点燃的镁条伸人充满二氧化碳的集气瓶中,不能继续燃烧B.常温下,铁与浓硝酸剧烈反应生成红棕色气体C.铁制品在潮湿的空气中...” 主要考查您对单质铁
镁的单质及其化合物
氯气
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铁
- 镁的单质及其化合物
- 氯气
铁元素:
在元素周期表中的位置:铁的原子序数26,位于周期表中第四周期,第Ⅷ族。
(1)物理性质:银白色、有金属光泽,密度较大,熔点较高,硬度较小,具有导电、导热、延展性,可被磁铁吸引。
(2)化学性质:较活泼的金属,+2、+3价两种价态
①与强氧化剂反应(如:Cl2 Br2 过量稀HNO3)生成+3价铁的化合物。如: 
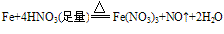
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S I2 H+ Cu2+)生成+2价铁的化合物,如: 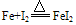
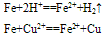
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁的性质:
- 物理性质:铁是黑色金属,具有铁磁性
- 铁的化学性质:
①与强氧化剂反应(如:Cl2、 Br2 、过量稀HNO3)生成+3价铁的化合物。如:
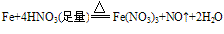
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S、 I2 、H+ 、Cu2+)生成+2价铁的化合物,如: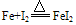
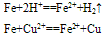
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁与稀硝酸的反应:
- 铁少量时:
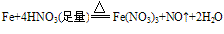
- 铁过量时:3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O
两式可通过2Fe3++Fe==3Fe2+联系起来。
注意:
- 铁元素性质活泼,自然界中的铁元素几乎都是以化合态存在,只有在陨石中存在游离态的铁元素。
- 过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行。
- 金属与强氧化性酸反应,不会生成H2。
化学性质:
铁元素性质活泼,有较强的还原性。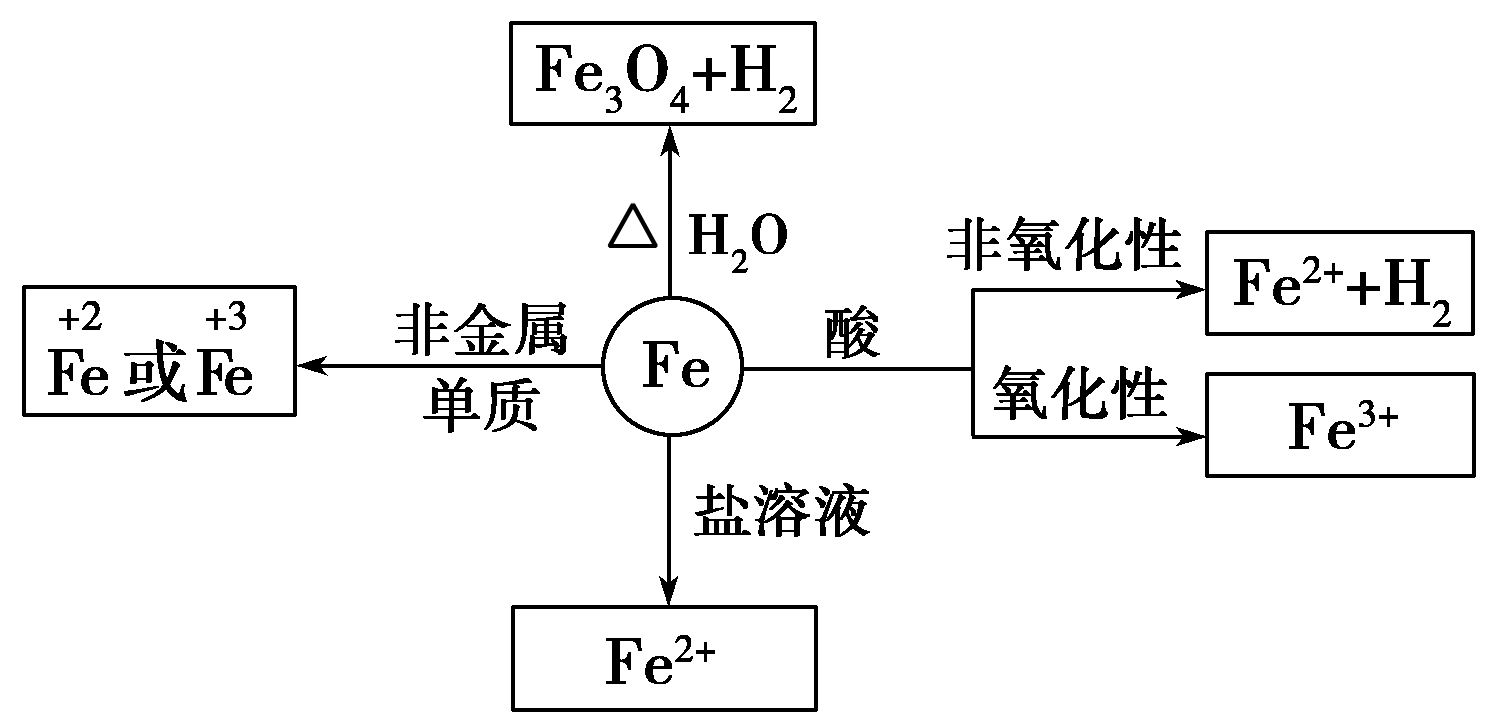
铁三角关系:

镁:
化学式Mg,它是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。镁元素在自然界广泛分布,是人体的必需元素之一,原子结构示意图: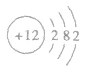 。
。
氧化镁:
化学式MgO是镁的氧化物,一种离子化合物。常温下为一种白色固体。氧化镁以方镁石形式存在于自然界中,是冶镁的原料。
氢氧化镁:
化学式Mg(OH)2,式量58.32。白色无定形粉末。难溶于水,易溶于稀酸和铵盐溶液。饱和水溶液的浓度为1.9毫克/升(18℃),呈碱性。加热到350℃失去水生成氧化镁。用做分析试剂,还用于制药工业。氧化镁跟水反应可得氢氧化镁。
镁及其化合物的物理性质和化学性质:
| 物理性质 | 化学性质 | |
| Mg | 银白色固体,密度1.738g﹒cm3-,熔点645℃,沸点1090℃,导电导热性较好,延展性较好 | ①镁和铝两元素的原子最外层分别有2个和3个电子。在参加化学反应时,容易失去最外层电子成为阳离子,表现还原性。 Mg-2e-==Mg2+ ②镁与非金属反应 O2+2Mg  2MgO 2MgOCl2+Mg  MgCl2 MgCl2 S+Mg  MgS MgS3Mg+N2  Mg3N2 Mg3N2 说明在常温下,镁能与空气里的氧气发生反应,生成一层致密的氧化物薄膜,从而使金属失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有抗腐蚀性。 ③镁与酸反应 2HCl+Mg==MgCl2+H2↑ 2H++Mg==Mg2++H2↑ 镁跟硝酸、浓硫酸反应时,硝酸中的氮元素、硫酸中的硫元素被还原,不生成氢气。 ④镁跟某些氧化物反应 2Mg+CO2  C+2MgO C+2MgO ⑤镁跟水反应 Mg+2H2O  Mg(OH)2+H2↑ Mg(OH)2+H2↑ 说明:镁跟冷水反应非常缓慢. |
| MgO | 白色固体,离子化合物,熔点为3073K,硬度(莫氏)为6.5,难溶于水的固体,熔点很高,是很好的耐火材料 | 典型的碱性氧化物,不能与水反应 |
| Mg(OH)2 | 白色难溶于水的固体,其水溶液中c(OH-)很小,可以使酚酞溶液变成浅红色 Mg(OH)2(s)  Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
①可与酸反应生成盐和水,如Mg(OH)2+2HCl==MgCl2+2H2O ②热稳定性差,受热容易分解 Mg(OH)2  MgO+H2O MgO+H2O |
工业制备镁:
电解熔融状态的氯化镁制取镁
阳极反应:2Cl--2e-==Cl2↑
阴极反应:Mg2++2e-==Mg
总反应:MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
Mg2++2Cl-==Mg+Cl2↑
说明氧化镁比氯化镁熔点高,为了降低能耗,工业电解制取镁采用的原料是氯化镁而不是氧化镁。
氧化镁的应用:
氧化镁可用于染料,油漆,玻璃,化学试剂,医药,食品添加剂等方面,工业上利用MgO熔点高的特点,制造耐火材料。
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: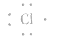
④氯的原子结构示意图: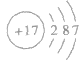
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 与“下列现象的描述正确的是( )A.点燃的镁条伸人充满二氧化碳...”考查相似的试题有:
- (13分)合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元...
- 将14g铜银合金与足量的一定浓度的硝酸溶液反应,把放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全部被吸收...
- 把生锈的铁钉放入足量稀盐酸中,可能发生的反应是( )A.只有置换反应B.只有复分解反应C.置换和复分解反应D.置换和分解反应
- 在含有硝酸铜、硝酸铁、硝酸银各0.1 mol的混合溶液中加入铁粉,充分反应后,析出3.2 g铜,则向溶液中加入的铁粉质量为 ( )A....
- 类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观事实.下列各种类比推测的说法中正...
- 固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。(1)写出下列...
- 取含MnO2的软锰矿石11.6 g跟足量浓盐酸反应(杂质不参与反应),制得2.24 L Cl2(标准状况),求:(1)这种软锰矿石中MnO2的...
- 实验室中制备HClO溶液的最好方法是将Cl2缓慢通入A.蒸馏水B.烧碱溶液C.纯碱溶液D.石灰石的悬浊液
- 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。(1)请写出MnO2和浓盐酸制备Cl2...
- A.它们都能以游离态存在于自然界B.它们的氧化物都能与强碱反应生成含氧酸盐C.气态氢化物的稳定性为CH4>SiH4D.N2和C在一定...