本试题 “(1)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)⇌2N2O5(g);若已知K350℃<K300℃,则该反应是______反应(填“吸热”或“放热”).反应...” 主要考查您对热化学方程式
勒夏特列原理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 热化学方程式
- 勒夏特列原理
热化学方程式:
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如: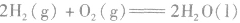 :
: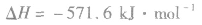 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
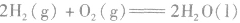 :
: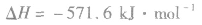 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
原理内容:
如果改变影响平衡的一个条件(如浓度、压强、温度),平衡将向着能够减弱这种改变的方向移动。勒夏特列原理又叫平衡移动原理。
适用范围:
平衡移动原理适用于化学平衡、溶解平衡、电离平衡、水解平衡等动态平衡。
注意事项:
(1)平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
(2)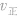 增大并不意味着平衡一定向正反应方向移动,只有
增大并不意味着平衡一定向正反应方向移动,只有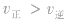 时才可以肯定平衡向正反应方向移动。
时才可以肯定平衡向正反应方向移动。
(3)当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
(4)存在平衡且平衡发生移动时才能应用平衡移动原理。
分析思路:
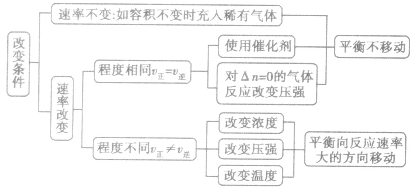
如果改变影响平衡的一个条件(如浓度、压强、温度),平衡将向着能够减弱这种改变的方向移动。勒夏特列原理又叫平衡移动原理。
适用范围:
平衡移动原理适用于化学平衡、溶解平衡、电离平衡、水解平衡等动态平衡。
注意事项:
(1)平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
(2)
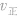 增大并不意味着平衡一定向正反应方向移动,只有
增大并不意味着平衡一定向正反应方向移动,只有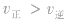 时才可以肯定平衡向正反应方向移动。
时才可以肯定平衡向正反应方向移动。 (3)当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
(4)存在平衡且平衡发生移动时才能应用平衡移动原理。
分析思路:

发现相似题
与“(1)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g...”考查相似的试题有:
- 反应2C + O2=2CO 的能量变化如图所示。含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的...
- 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据下图回...
- 下列有关热化学方程式的叙述正确的是[ ]A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液...
- 同温同压下,已知下列各反应为放热反应,下列各热化学方程式中反应热最小的是[ ]A.2A ( l ) + B ( l ) = 2C (g ) △H1B.2A (...
- 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重...
- 能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.(1)工...
- 最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇...
- 已知⑴ H2(g)+1/2 O2(g)====H2O(g) ; △H1=a kJ·mol-1⑵ 2H2(g)+ O2(g)===2H2O(g) ; △H2=b kJ·mol-1⑶ H2(g)+1/2O2(g)====H...
- 对于反应2A(g)+xB(g)⇌4C(g)达到平衡时 C的浓度为1.2mol•L-1,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol•L...
- 不能用化学平衡移动原理说明的事实是[ ]A.合成氨在高压下进行是有利的B.温度过高对合成氨不利C.使用催化剂能使合成氨速率...