本试题 “下列物质间的转化能一步实现的是( )A.SiO2→H2SiO3B.S→SO3C.N2→NO2D.Cl2→FeCl3” 主要考查您对单质硅
二氧化硅
氯气
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质硅
- 二氧化硅
- 氯气
硅:
①元素符号:Si
②原子结构示意图: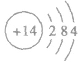
③电子式: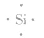
④周期表中位置:第三周期ⅣA族
⑤含量与存在:在地壳中的含量为26.3%,仅次于氧,在自然界中只以化合态存在
⑥同素异形体:晶体硅和无定形硅
硅的物理性质和化学性质:
(1)物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体,它的结构类似金刚石,具有较高的沸点和熔点,硬度也很大,它的导电性介于导体和绝缘体之间,是良好的半导体材料。 (2)化学性质:化学性质不活泼
①常温下,除与氟气、氢氟酸及强碱溶液反应外,与其他物质不反应 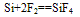
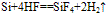 (雕刻玻璃)
(雕刻玻璃)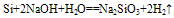
②在加热条件下,能与氧气、氯气等少数非金属单质化合
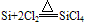
(4)制备:在电炉里用碳还原二氧化硅先制得粗硅: ,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为:
,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为: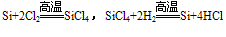 。
。
碳族元素中碳和硅的一些特殊规律:
1.金刚石和晶体硅都是原子晶体,但金刚石不导电,晶体硅能导电.且金刚石的熔点(大于3550℃)比硅的熔点(1410℃)高;石墨是过渡型晶体或混合型晶体,也能导电。
2.碳和硅都能跟O2反应生成氧化物,碳的两种氧化物CO和CO2在常温下是气体,而硅的氧化物SiO2 在常温下是固体。
3.碳跟碱溶液不反应,而硅跟碱溶液能反应。
Si+2NaOH+H2O==Na2SiO3+2H2↑
4.碳在高温时能跟水蒸气反应,而硅不能。
C+H2O(g) CO+H2
CO+H2
5.碳跟氢氟酸不反应,而硅能跟氢氟酸反应。
Si+4HF==SiF4↑+2H2↑
6.碳能被浓硫酸(或浓硝酸)氧化生成二氧化碳,但硅不能被浓硫酸(或浓硝酸)氧化。
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
C+4HNO3(浓) 4NO2↑+2H2O+CO2↑
4NO2↑+2H2O+CO2↑
7.碳和硅都具有还原性,且硅的还原性比碳强,但在高温时碳能把硅从SiO2中还原出来。
2C+SiO2 Si+2CO↑
Si+2CO↑
8.碳的氯化物都不能自燃,而SiH4能自燃。
SiH4+2O2==SiO2+2H2O
9.通常情况下,周态CO、CO2都是分子晶体,熔、沸点都很低;而SiO2是原子晶体,熔、沸点较高。
10.CO2溶于水且能跟水反应生成碳酸,SiO2却不能.
11.CO2跟氢氟酸不反应,而SiO2能跟氢氟酸反应.
SiO2+4HF==SiF4↑+2H2O
12.CO2跟碱溶液反嘘生成正盐或酸式盐,而SiO2 跟碱溶液反应只生成正盐。
CO2+2NaOH==Na2CO3+H2O
CO2+NaOH==NaHCO3
SiO2+2NaOH==Na2SiO3+H2O
13.在溶液中Na2SiO3可转变为Na2CO3,而在高温条件下Na2CO3又可转变为Na2SiO3。
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
硅及其化合物的几种反常现象:
1.Si的还原性大于C,但C却能在高温下还原出Si 可从平衡移动的角度理解,由于高温下生成了气态物质CO2它的放出降低了生成物的浓度,有利于应反正向进行,故可发生反应:SiO2+2C Si+2CO↑
Si+2CO↑
2.部分非金属单质能与碱溶液反应,但其中只有 Si与碱反应放出H2 常见的非金属单质与碱溶液的反应有:
Cl2+2NaOH==NaCl+NaClO+H2O①
3S+6NaOH 2Na2S+Na2SO3+3H2O②
2Na2S+Na2SO3+3H2O②
Si+2NaOH+H2O==Na2SiO3+2H2↑③
在反应①②中,Cl2、S既作氧化剂又作还原剂:在反应③中,Si为还原剂。
3.非金属单质一般不与弱氧化性酸反应,而硅不但能与氢氟酸反应,而且还会产生H2
4.硅酸不能由相应的酸酐与水反应制得制取硅酸的实际过程很复杂,条件不同可得到不同的产物,通常包括原硅酸(H2SiO4)及其脱水得到的一系列酸。原硅酸经两步脱水变为SiO2,SiO2是硅酸的酸酐,是一种不溶于水的同体,不能直接用它制备硅酸,用SiO2制取硅酸时,可先将SiO2溶于烧碱中,再向溶液中加入足量的盐酸或通入过量的CO2,析出的胶状物就是原硅酸,将原硅酸在空气中脱水即得硅酸,反应原理可理解为:
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+CO2+2H2O==Na2CO3+H4SiO4↓
H4SiO4==H2SiO3+H2O
5.非金属氧化物的熔沸点一般较低,但SiO2的熔沸点却很高非金属氧化物一般为分子晶体,但SiO2为原子晶体。分子晶体中分子以分子问作用力相结合,而分子间作用力很弱,破坏它使晶体变为液体或气体比较容易;而在SiO2晶体中每个硅原子与四个氧原子相结合,形成硅氧四面体,在每个硅氧四面体结构单元中Si—O 键的键能很高,同时硅氧四面体结构单元可通过共用顶角氧原子连成立体网状结构,所以要使它熔融,必须消耗更多的能量,因此SiO2的熔沸点很高。
6.SiO2是酸性氧化物却能跟HF作用
SiO2+4HF==SiF4↑+2H2O,此反应并不是因为HF的酸性,而是因为为常温下SiF4为气态物质,有利于反应正向进行,这是SiO2的突出特性,当然也是HF 的特性。
7.H2CO3的酸性强于H2SiO3。但却能发生如下反应:Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
强酸制备弱酸作为判断反应方向的依据,只适用于水溶液体系,而在非水溶液的条件下不一定适用,在高温下能发生反应:Na2CO3+SiO2 Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
2NaCl+H2SO4(浓) Na2SO4+2HCl↑
Na2SO4+2HCl↑
NaNO3+H2SO4(浓) NaHSO4+HNO3↑
NaHSO4+HNO3↑
上述两反应并不是由于H2SO4的强酸性,而是由于H2SO4为高沸点酸,HCl、HNO3为低沸点酸。
硅的用途:
高纯硅可作半导体材料,制造集成电路、晶体管、硅整流器等半导体器件,还可以制造太阳能电池。硅的合金用途也很广,如含硅4%的钢具有良好的导磁性,可用来制造变压器的铁芯;含硅15%左右的钢具有良好的耐酸性,可用来制造耐酸设备。
二氧化硅:
①化学式SiO2
②相对分子质量:60
③类别:酸性氧化物
④晶体类型:原子晶体
⑥晶体中粒子间的作用力:共价键
二氧化硅的物理性质和化学性质:
(1)物理性质:无色透明或白色粉末,原子晶体,熔沸点都很高,坚硬难熔,不溶于水,天然的二氧化硅俗称硅石,是构成岩石的成分之一。
(2)化学性质:不活泼
①不与水反应,不能跟酸(氢氟酸除外)发生反应。
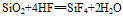 (氢氟酸不能盛放在玻璃容器中)。
(氢氟酸不能盛放在玻璃容器中)。②具有酸性氧化物的性质,能跟碱性氧化物或强碱反应。
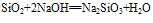 (实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
(实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
 (制玻璃)
(制玻璃)③具有弱氧化性


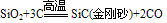
知识点拨:
二氧化硅晶体的结构若在硅晶体结构中的每个Si—Si键中“插入”一个氧原子,便可得到以硅氧四面体 (SiO4)为骨架的二氧化硅的结构,如图所示。在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,即每个硅原子与四个氧原子形成四个共价键,每个氧原子与两个硅原子形成共价键,因此,二氧化硅晶体中硅原子和氧原子的个数比为1:2,二氧化硅的化学式为SiO2.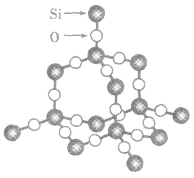
二氧化硅的用途:
①光导纤维的主要原料
②石英的主要成分是SiO2,纯净的石英可用来制造石英玻璃。石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。 水晶常用来制造电子工业中的重要部件、光学仪器,也用来制造高级工艺品和眼镜片。
③玛瑙石含有有色杂质的石英晶体,可用于制造精密仪器轴承,耐磨器皿和装饰品。
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: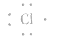
④氯的原子结构示意图: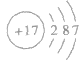
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 与“下列物质间的转化能一步实现的是( )A.SiO2→H2SiO3B.S→SO3...”考查相似的试题有:
- 下列有关物质性质叙述中正确的是( )A.氯气与水反应生成的次氯酸具有强氧化性,可用于漂白B.二氧化硅的化学性质很不活泼,...
- 某硅酸锌样品含58.6%的锌,而ZnO%与SiO2%的质量分数的总和为100%,写出这样品的化学式(最简式)。
- 下列说法错误的是[ ]A.硅是制造太阳能电池的常用材料B.二氧化硅是制造光导纤维的材料C.常温下硅性质活泼,可以与氯气、强...
- 下列表述正确的是[ ]①人造刚玉溶点很高,可用作高级耐火材料,主要成分是二氧化硅②化学家采用玛瑙研钵摩擦固体反应物进行无溶...
- “3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要.下列物质中用于制造光导纤维的材料是( )A.铜合金B.陶瓷C.聚...
- 某混合气体可能含有N2、HCl和CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体的体积都没有变化。再通过足量的Na2O2...
- 氯气可以用来消灭田鼠,使用方法是将氯气通过软管灌入田鼠洞中,这是利用了氯气以下性质中的①黄绿色 ②密度比空气大 ③有毒 ④较...
- 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。下图是实验室制备氯气并进行一系列相关实验的...
- 氯气跟下列物质反应时,能够产生白雾的是[ ]A.NaB.CuC.H2D.Fe
- 关于下列褪色现象原理是否相同的认识中,正确的一组是( )①二氧化硫使品红溶液褪色 ②活性炭使红墨水褪色 ③氯水使红色布条褪...