本试题 “某反应的反应过程中能量变化如图1 所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是[ ]A. 该反应为放热反应B. 催化剂能改变该反...” 主要考查您对吸热反应、放热反应
活化分子、活化能、有效碰撞
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 活化分子、活化能、有效碰撞
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
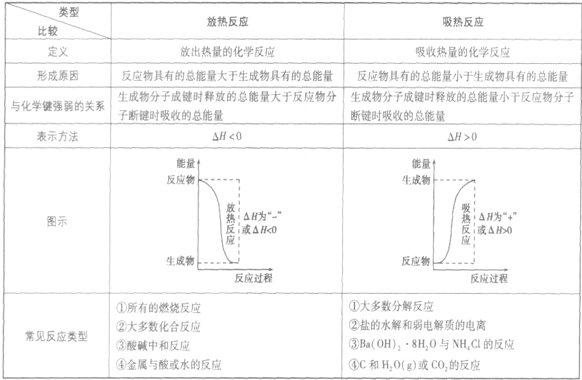
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

有效碰撞与活化分子:
1.化学反应过程就是反应物分子分裂成原子,原子重新组合成生成物分子的过程,也就是反应物分子中化学键断裂、生成物分子中化学键形成的过程。
2.旧键的断裂和新键的形成都是通过反应物分子 (或离子)的相互碰撞来实现的。反应物分子(或离子)问的碰撞是化学反应发生的先决条件,但并不是反应物分子的每次碰撞都能发生化学反应。
3.能够发生化学反应的分子碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫做活化分子。活化分子具有比普通分子(非活化分子)更高的能量。活化分子在碰撞后有可能使原子问的化学键断裂,从而导致化学反应的发生。但并不是活化分子的每次碰撞都能引起化学反应。
4.分子间的自由碰撞必然会有不同的碰撞取向。研究发现,有效的分子碰撞,分子除了要有足够的能量以外,还要有合适的碰撞取向。从分子能量的方面来看,活化分子具备发生有效碰撞的条件。从分子碰撞取向的方向来看,活化分子的某次碰撞并不一定能引发化学反应。若活化分子碰撞取向合适,才能发生化学反应;若活化分子碰撞取向不合适,则化学反应不能发生。也就是说,只有活化分子以合适的取向发生碰撞,才能使分子内的化学键断裂,从而引发化学反应。或者说,具有较高能量的活化分子按照合适的取向所发生的有效碰撞才能引发化学反应。
5.为了把“有效碰撞”概念具体化,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子所多出来的那部分能量叫做活化能,因此活化能是活化分子平均能量与普通反应物分子平均能量的差值。
6.活化能相当于化学反应的“门槛”,对于同一化学反应,其活化能越低,反应速率越快。催化剂就是通过参与反应,改变反应历程,降低反应的活化能来提高反应速率的。
1.化学反应过程就是反应物分子分裂成原子,原子重新组合成生成物分子的过程,也就是反应物分子中化学键断裂、生成物分子中化学键形成的过程。
2.旧键的断裂和新键的形成都是通过反应物分子 (或离子)的相互碰撞来实现的。反应物分子(或离子)问的碰撞是化学反应发生的先决条件,但并不是反应物分子的每次碰撞都能发生化学反应。
3.能够发生化学反应的分子碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫做活化分子。活化分子具有比普通分子(非活化分子)更高的能量。活化分子在碰撞后有可能使原子问的化学键断裂,从而导致化学反应的发生。但并不是活化分子的每次碰撞都能引起化学反应。
4.分子间的自由碰撞必然会有不同的碰撞取向。研究发现,有效的分子碰撞,分子除了要有足够的能量以外,还要有合适的碰撞取向。从分子能量的方面来看,活化分子具备发生有效碰撞的条件。从分子碰撞取向的方向来看,活化分子的某次碰撞并不一定能引发化学反应。若活化分子碰撞取向合适,才能发生化学反应;若活化分子碰撞取向不合适,则化学反应不能发生。也就是说,只有活化分子以合适的取向发生碰撞,才能使分子内的化学键断裂,从而引发化学反应。或者说,具有较高能量的活化分子按照合适的取向所发生的有效碰撞才能引发化学反应。
5.为了把“有效碰撞”概念具体化,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子所多出来的那部分能量叫做活化能,因此活化能是活化分子平均能量与普通反应物分子平均能量的差值。
6.活化能相当于化学反应的“门槛”,对于同一化学反应,其活化能越低,反应速率越快。催化剂就是通过参与反应,改变反应历程,降低反应的活化能来提高反应速率的。
发现相似题
与“某反应的反应过程中能量变化如图1 所示(图中E1表示正反应的活...”考查相似的试题有:
- 下列有关物质分类或归类正确的是( )①混合物:盐酸、氯水、水银 ②化合物:CaCl2、NaOH、HD③电解质:胆矾、冰醋酸、氯化银 ④...
- 如图所示,图像表示某一反应过程中的能量变化曲线。下列说法中不正确的是[ ]A.由图可知,该反应为放热反应B.该反应的焓变为...
- 根据事实进行填空:①木炭的不完全燃烧②铝热反应③CO2+C 高温 . 2CO④氢氧化钡晶体与氯化铵晶体混合:Ba(OH)2•8H2O+2NH4Cl═2NH...
- 为了研究化学反应X+Y=Z的能量变化情况,某同学设计了右图所示装置.当向盛有X的试管中滴加试剂Y时,看到U型管中甲处液面下降...
- 以下属于需吸收能量的氧化还原反应的是( )A.NaOH固体溶于水B.煅烧石灰石制生石灰C.Ba(OH)2•8H2O晶体与NH4Cl晶体混合、...
- 下列化学反应属于吸热反应的是( )A.碘的升华B.生石灰溶于水C.镁与稀盐酸反应D.氢氧化钙与氯化铵晶体混合
- 下列说法正确的是[ ]A.需要加热方能发生的反应一定是吸热反应B.放热的反应在常温下一定很容易发生C.反应是放热还是吸热,...
- 下列有关说法正确的是[ ]A. 化学反应中反应物总能量可能大于、小于或等于生成物的总能量B. 吸热反应不一定需要加热C. 硝酸铵...
- “摇摇冰”是一种即用即饮的饮料.吸食时,将饮料罐隔离层中的化学物质和水混合后摇动即会制冷.该化学物质是( )A.氯化钠B....
- 2010上海世博会成为第一个“低碳世博”。主办方确定以“低碳、和谐、可持续发展的城市”为主题,将大量新能源、节能环保科技成果...