本试题 “请从氧气、氮气、二氧化碳、二氧化硫等四种气体中,按要求将相应物质填写在题中的空白处。(1)属于空气污染物的气体是____;(2)能支持燃烧的气体是______;(3)...” 主要考查您对空气的污染和防治
氧气的性质
氮气的性质和用途
二氧化碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 空气的污染和防治
- 氧气的性质
- 氮气的性质和用途
- 二氧化碳的性质
即空气中含有一种或多种污染物,其存在的量、性质及时间会伤害到人类、植物及动物的生命,损害财物、或干扰舒适的生活环境,如臭味的存在。换言之,只要是某一种物质其存在的量,性质及时间足够对人类或其他生物、财物产生影响者,我们就可以称其为空气污染物;而其存在造成之现象,就是空气污染。换言之,某些物质在空气中不正常的增量就产生空气污染的情形。
空气污染治理:
1. 空气污染及来源
导致空气质量下降的污染物很多。目前量多且危害严重的空气污染物主要有二氧化硫(SO2)、氮氧化物 (NO2)、一氧化碳(CO)和可吸入颗粒物等。如下表所示:
| 空气污染物 | 主要来源 |
| 二氧化硫 | 煤、石油等燃料的燃烧,生产硫酸等工厂排放的尾气 |
| 一氧化碳 | 化石燃料等不完全燃烧 |
| 氮氧化物 | 机动车辆等排放的废气 |
| 可吸入颗粒物 | 地面扬尘、燃煤排放的粉尘等 |
2. 空气污染的危害
①酸雨:SO2、NOx等气体形成酸雨。
②臭氧层破坏:氟利昂的释放,加速臭氧分解。
③其他危害:空气污染严重危害了人体健康,影响了农作物生长,破坏了生态平衡。
3. 空气污染的防治
①改善燃料结构,尽量充分燃烧液体燃料和气体燃料。
②对化石燃料进行脱硫、脱氮处理,工厂的废气要经过处理再排放。
③开发新能源,如太阳能、风能、水能、地热能等。
④大力开展植树造林活动,提高环境的自我净化能力。
空气质量日报:
空气质量日报的主要内容:空气污染指数,首要污染物,空气质量级别,空气质量状况。
计入空气污染指数的项目:二氧化硫,一氧化碳,二氧化氮,可吸入颗粒物,臭氧等。
空气质量级别:
| 污染指数 | 50以下 | 51-100 | 101-150 | 151-200 | 201-250 | 251-300 | 300以上 |
| 质量级别 | Ⅰ | Ⅱ | Ⅲ⑴ | Ⅲ⑵ | Ⅳ⑴ | Ⅳ⑵ | Ⅴ |
| 质量状况 | 优 | 良 | 轻微污染 | 轻度污染 | 中度污染 | 中度重污染 | 重度污染 |
PM2.5
(1)什么是PM2.5:PM2.5是指大气中小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。它的直径还不到人的头发丝粗细的1/20。虽然PM2.5只是地球大气成分中含量很少的组分,但对空气质量和能见度等有重要影响。
(2)PM2.5的性状:与较粗的大气颗粒物相比,PM2.5粒径小,富含大量的有毒,有害物质且能在大气中停留时间长,输送距离远,因而对人体健康和大气环境质量的影响更大。
(3)PM2.5的来源:主要来源是日常发电,工业生产,汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属的等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自道路扬尘等,2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(机动车尾气,燃烧)、挥发性有机物等。
(4)2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标。
室内空气污染:
指由于各种原因导致的室内空气中有害物质超标.进而影响人体健康的室内环境污染。有害物质包括甲醛、苯、氨、放射性物质等。
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体)
 液氮(淡蓝色液体)
液氮(淡蓝色液体)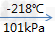 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2
 2MgO
2MgO3Fe+2O2
 Fe3O4
Fe3O4②与非金属的反应:
C+O2
 CO2(O2充分)
CO2(O2充分)2C+O2
 2CO(O2不充分)
2CO(O2不充分)③与化合物的反应:
2CO+O2
 2CO2
2CO2CH4+2O2
 CO2+2H2O
CO2+2H2OC2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
氮气,常况下是一种无色无味无臭的气体,且通常无毒。氮气占大气总量的78.12%(体积分数),是空气的主要成份。常温下为气体,在标准大气压下,冷却至-195.8℃时,变成没有颜色的液体,冷却至-209.86℃时,液态氮变成雪状的固体。氮气的化学性质很稳定,常温下很难跟其他物质发生反应,但在高温、高能量条件下可与某些物质发生化学变化,用来制取对人类有用的新物质。
物理性质:
(1)无色无味的气体
(2)不易溶于水
(3)在标准状况下密度为1.251g/L,密度比空气略小
化学性质:
化学性质不活泼,一般情况下不能燃烧,也不支持燃烧;在常温下难与其他物质发生反应,但在高温下也能与一些物质发生化学反应。
用途:
(1)焊接金属时做保护气
(2)灯泡中填充氮气以延长灯泡的使用寿命,食品包装袋中充有氮气以防止食品腐烂变质
(3)医疗上可以在液氮冷冻麻醉的条件下做手术
(4)超导材料在液氮的低温环境下能显示超导性能
(5)制造氮肥和硝酸
(6)有些博物馆把贵重罕见的书画,墨宝保存在充满氮气的圆筒中,既可以避免氧化变质,又可防止虫蛀霉变。
氮的化学性质:
1. 氮化物反应
氮化镁与水反应:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
在放电条件下,氮气才可以和氧气化合生成一氧化氮:N2+O2=放电=2NO
一氧化氮与氧气迅速化合,生成二氧化氮2NO+O2=2NO2
二氧化氮溶于水,生成硝酸,一氧化氮3NO2+H2O=2HNO3+NO
五氧化二氮溶于水,生成硝酸,N2O5+H2O=2HNO3
2. 氮和活泼金属反应
N2与金属锂在常温下就可直接反应:6Li+N2===2Li3N
N2与碱土金属Mg、Ca、Sr、Ba在炽热的温度下作用:3Ca+N2===Ca3N2
N2与镁条反应:3Mg+N2=点燃=Mg3N2(氮化镁)
3. 氮和非金属反应
N2与氢气反应制氨气:N2+3H2===(可逆符号)2NH3
N2与硼要在白热的温度才能反应:2B+N2===2BN(大分子化合物)
N2与硅和其它族元素的单质一般要在高于1473K的温度下才能反应。
氮气用途——汽车轮胎
1.提高轮胎行驶的稳定性和舒适性
氮气几乎为惰性的双原子气体,化学性质极不活泼,气体分子比氧分子大,不易热胀冷缩,变形幅度小,其渗透轮胎胎壁的速度比空气慢约30~40%,能保持稳定胎压,提高轮胎行驶的稳定性,保证驾驶的舒适性;氮气的音频传导性低,相当于普通空气的1/5,使用氮气能有效减少轮胎的噪音,提高行驶的宁静度。
2.防止爆胎和缺气碾行
爆胎是公路交通事故中的头号杀手。据统计,在高速公路上有46%的交通事故是由于轮胎发生故障引起的,其中爆胎一项就占轮胎事故总量的70%。汽车行驶时,轮胎温度会因与地面磨擦而升高,尤其在高速行驶及紧急刹车时,胎内气体温度会急速上升,胎压骤增,所以会有爆胎的可能。而高温导致轮胎橡胶老化,疲劳强度下降,胎面磨损剧烈,又是可能爆胎的重要因素。而与一般高压空气相比,高纯度氮气因为无氧且几乎不含水份不含油,其热膨胀系数低,热传导性低,升温慢,降低了轮胎聚热的速度,不可燃也不助燃等特性,所以可大大地减少爆胎的几率。
3.延长轮胎使用寿命
使用氮气后,胎压稳定体积变化小,大大降低了轮胎不规则磨擦的可能性,如冠磨、胎肩磨、偏磨,提高了轮胎的使用寿命;橡胶的老化是受空气中的氧分子氧化所致,老化后其强度及弹性下降,且会有龟裂现象,这时造成轮胎使用寿命缩短的原因之一。氮气分离装置能极大限度地排除空气中的氧气、硫、油、水和其它杂质,有效降低了轮胎内衬层的氧化程度和橡胶被腐蚀的现象,不会腐蚀金属轮辋,延长了轮胎的使用寿命,也极大程度减少轮辋生锈的状况。
4.减少油耗,保护环境
轮胎胎压的不足与受热后滚动阻力的增加,会造成汽车行驶时的油耗增加;而氮气除了可以维持稳定的胎压,延缓胎压降低之外,其干燥且不含油不含水,热传导性低,升温慢的特性,减低了轮胎行走时温度的升高,以及轮胎变形小抓地力提高等,降低了滚动阻力,从而达到减少油耗的目的。
二氧化碳是空气中常见的化合物,其分子式为CO?,由两个氧原子与一个碳原子通过共价键连接而成,常温下是一种无色无味气体,密度比空气略大,能溶于水,与水反应生成碳酸。固态二氧化碳俗称干冰。二氧化碳被认为是造成温室效应的主要来源。
物理性质:
常温下,二氧化碳是一种无色无味的气体,密度比空气大,能溶于水。
固态的二氧化碳叫做干冰。
化学性质:
(1)一般情况下,二氧化碳不能燃烧,也不支持燃烧,不供给呼吸,因此当我们进入
干枯的深井,深洞或久未开启的菜窖时,应先做一个灯火实验,以防止二氧化碳浓度
过高而造成危险
(2)二氧化碳和水反应生成碳酸,使紫色石蕊试液变红:CO2 + H2O===H2CO3,
碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变回紫色:
H2CO3===H2O + CO2↑
(3)二氧化碳和石灰水反应:Ca(OH)2 + CO2====CaCO3↓+ H2O
(4)二氧化碳可促进植物的光合作用:6CO2+6H2O
 C6H12O6+6O2
C6H12O6+6O2 一氧化碳和二氧化碳性质的比较:
|
|
|
一氧化碳 |
二氧化碳 |
|
物理性质 |
状态 |
无色,无味气体 |
无色,无味气体 |
|
密度 |
1.250g/l(略小于空气) |
1.977g/l(大于空气) | |
|
溶解性 |
1体积水中约溶解0.02体积 |
1体积中约溶解1体积 | |
|
化学性质 |
可燃性 |
有可燃性 |
一般情况下,既不能燃烧,也不能支持燃烧 |
|
还原性 |
有还原性: |
没有还原性 | |
|
跟水反应 |
不能 |
能:CO2+H2O==H2CO3 | |
|
跟澄清石灰水反应 |
不能 |
CO2+Ca(OH)2==CaCO3↓+H2O | |
|
毒性 |
有毒 |
无毒 | |
|
主要用途 |
作气体燃料,用于高炉炼铁 |
灭火,人工降雨,干冰制冷剂等,作化工原料和温室肥料 | |
|
相互转化 |
C+O2 CO2 CO2C+CO2  2CO 2CO | ||
干冰:
一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫“干冰”。干冰升华时,吸收大量的热,因此可作制冷剂。如果用飞机向云层中撤干冰,由于干冰升华吸热,空气中的水蒸气迅速冷凝变成水滴,就可以形成降雨。
二氧化碳不一定能灭火:
二氧化碳一般不支持燃烧,但在一定条件下,某些物质也可以在二氧化碳中燃烧,如将点燃的镁条伸入盛有二氧化碳的集气瓶中,镁条能继续燃烧,反应的化学方程式为:2Mg+CO2
 2MgO+C,所以活泼金属着火不能用二氧化碳来灭火
2MgO+C,所以活泼金属着火不能用二氧化碳来灭火 二氧化碳与一氧化碳的鉴别方法:
(1)澄清石灰水:将气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,无明显现象的是一氧化碳。
(2)燃着的木条:将气体分别在空气中点燃,能燃烧的是一氧化碳,不能燃烧的是二氧化碳。
(3)紫色石蕊试液:将气体分别通入紫色石蕊试液中,能使石蕊试液变红的是二氧化碳,无明显现象的是一氧化碳。
(4)还原金属氧化物:将气体分别通过灼热的氧化铜,出现黑色粉末变红这一现象的是一氧化碳,没有明显现象的是二氧化碳。
二氧化碳与一氧化碳的除杂方法:
1.CO(CO2)(括号内的物质为杂质):通常将气体通人过量的碱溶液(一般用氢氧化钠溶液而不用澄清石灰水)中,二氧化碳与碱溶液反应,从而达到除杂的目的。
2.CO2(CO)(括号内的物质为杂质):通常将气体通过灼热的氧化铜,一氧化碳与氧化铜反应生成铜和二氧化碳,从而达到除杂的目的。不能用点燃的方法,因为CO2不支持燃烧,也不能燃烧。
二氧化碳与石灰石的应用:
二氧化碳与石灰水反应出现白色沉淀,反应的方程式为:CO2+Ca(OH)2==CaCO3↓+H2O。
该反应及现象有以下儿方面的应用:
(1)检验二氧化碳气体;
(2)鉴别NaOH溶液和澄清石灰水:将CO2气体通入待测溶液中,生成白色沉淀的溶液为澄清石灰水,无明显现象的为NaOH溶液;
(3)除去某些气体中的杂质:如除去CO中的CO2 气体,可将混合气体通过澄清石灰水;
(4)解释澄清石灰水为什么要密封保存:敞口放置的澄清石灰水会吸收空气中的CO2而使澄清石灰水表面生成一层白膜或变浑浊,其成分是CaCO3;
(5)用石灰砂浆砌砖抹墙不久后变白变硬:石灰砂浆的主要成分是Ca(OH)2,吸收空气中的CO2发生反应Ca(OH)2声称白色固体CaCO3固体。
(6)保存鸡蛋:将鸡蛋浸泡在澄清石灰水中,取出来后CO2与石灰水反应封闭鸡蛋壳上的小孔,可以延长鸡蛋的保存时间。
二氧化碳肥料:
二氧化碳是光合作用的原料之一,因而现在在温室大棚内种植蔬菜水果时,经常人为提高温室内CO2 浓度,以增加农作物产员,增大CO2浓度的方法通常有以下几种:
(1)在温室内放置干冰,干冰升华增大CO2浓度。
(2)在温室内放置通过化学反应产生CO2气体的物质,如在塑料大棚顶部的容器内放置石灰石和稀盐酸。
灯火实验:
(1)二氧化碳本身无毒,但它不供给呼吸,当空气中二氧化碳含量超过常量时,也会对人体健康产生不良影响。
| 空气中二氧化碳的体积分数/% | 对人体健康的影响 |
| 1 | 感到气闷,头昏,心悸 |
| 4—5 | 气喘,头痛,眩晕 |
| 10 | 神志不清,呼吸停止,死亡 |
与“请从氧气、氮气、二氧化碳、二氧化硫等四种气体中,按要求将...”考查相似的试题有:
- 环境保护是当前世界发展的重要课题.下列治理相关污染的措施可行的是( )ABCD污染温室效应水体污染酸 雨沙尘暴防治措施使用...
- 用恰当的化学用语填空.(1)地壳中含量最多的金属元素与非金属元素组成的化合物______;(2)世博“零碳管”是中国第一座零碳...
- 专家揭秘发射“嫦娥一号”的“长三甲”火箭燃料有毒,但其燃烧后的主要产物均无毒性,因此不会对环境造成污染.发射完15min后,中...
- 对下列实验中出现异常情况的原因分析,不合理的是A.测定空气中氧气的含量时,气体减小的体积小于1/5——红磷过量B.点燃氢气时...
- 为了减缓二氧化碳使全球变暖的趋势,有科学家提出大胆设想:将排放到空气中的二氧化碳压缩使其液化,然后将其压入到冰冷的海...
- “雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊溶液中,然后再加热,溶液颜色变化是[ ]A. 先变蓝色后变紫色B. 变红后...
- 将两只用于医学研究的小白鼠分别放人A、B两个瓶中,A瓶内装有CO和O2的混合气体,B瓶内装有CO2气体,拧紧瓶盖,结果两只小白鼠...
- 生产、生活、学习中都应注意安全,请将下列情况和对应的安全措施用线条连接起来.(1)进入久未开启的菜窖前 ①严禁烟火(2)...
- 某化学兴趣小组的同学,为了探究石灰石的纯度,做了如下实验:取石灰石样品12.0g,放入一个大烧杯中,加入100g稀盐酸,待完全...
- A、B、C、D、E、F是初中化学常见的六种物质,化学兴趣小组同学设计了下图所示的接龙游戏,箭头表示一种物质可以转化成另一种...
 2CO2
2CO2 Cu+CO2
Cu+CO2