本试题 “海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和金属镁的制备原料都来自于海水。(I)在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如下图1所示...” 主要考查您对镁的单质及其化合物
电解饱和氯化钠溶液
氯碱工业
工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 镁的单质及其化合物
- 电解饱和氯化钠溶液
- 氯碱工业
- 工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
镁:
化学式Mg,它是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。镁元素在自然界广泛分布,是人体的必需元素之一,原子结构示意图: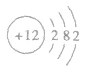 。
。
氧化镁:
化学式MgO是镁的氧化物,一种离子化合物。常温下为一种白色固体。氧化镁以方镁石形式存在于自然界中,是冶镁的原料。
氢氧化镁:
化学式Mg(OH)2,式量58.32。白色无定形粉末。难溶于水,易溶于稀酸和铵盐溶液。饱和水溶液的浓度为1.9毫克/升(18℃),呈碱性。加热到350℃失去水生成氧化镁。用做分析试剂,还用于制药工业。氧化镁跟水反应可得氢氧化镁。
镁及其化合物的物理性质和化学性质:
| 物理性质 | 化学性质 | |
| Mg | 银白色固体,密度1.738g﹒cm3-,熔点645℃,沸点1090℃,导电导热性较好,延展性较好 | ①镁和铝两元素的原子最外层分别有2个和3个电子。在参加化学反应时,容易失去最外层电子成为阳离子,表现还原性。 Mg-2e-==Mg2+ ②镁与非金属反应 O2+2Mg  2MgO 2MgOCl2+Mg  MgCl2 MgCl2 S+Mg  MgS MgS3Mg+N2  Mg3N2 Mg3N2 说明在常温下,镁能与空气里的氧气发生反应,生成一层致密的氧化物薄膜,从而使金属失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有抗腐蚀性。 ③镁与酸反应 2HCl+Mg==MgCl2+H2↑ 2H++Mg==Mg2++H2↑ 镁跟硝酸、浓硫酸反应时,硝酸中的氮元素、硫酸中的硫元素被还原,不生成氢气。 ④镁跟某些氧化物反应 2Mg+CO2  C+2MgO C+2MgO ⑤镁跟水反应 Mg+2H2O  Mg(OH)2+H2↑ Mg(OH)2+H2↑ 说明:镁跟冷水反应非常缓慢. |
| MgO | 白色固体,离子化合物,熔点为3073K,硬度(莫氏)为6.5,难溶于水的固体,熔点很高,是很好的耐火材料 | 典型的碱性氧化物,不能与水反应 |
| Mg(OH)2 | 白色难溶于水的固体,其水溶液中c(OH-)很小,可以使酚酞溶液变成浅红色 Mg(OH)2(s)  Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
①可与酸反应生成盐和水,如Mg(OH)2+2HCl==MgCl2+2H2O ②热稳定性差,受热容易分解 Mg(OH)2  MgO+H2O MgO+H2O |
工业制备镁:
电解熔融状态的氯化镁制取镁
阳极反应:2Cl--2e-==Cl2↑
阴极反应:Mg2++2e-==Mg
总反应:MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
Mg2++2Cl-==Mg+Cl2↑
说明氧化镁比氯化镁熔点高,为了降低能耗,工业电解制取镁采用的原料是氯化镁而不是氧化镁。
氧化镁的应用:
氧化镁可用于染料,油漆,玻璃,化学试剂,医药,食品添加剂等方面,工业上利用MgO熔点高的特点,制造耐火材料。
在小烧杯(或U型管)里装入饱和食盐水,滴入几滴酚酞试液。用导线把碳棒、电池、电流表和铁钉相连(如图)。接通直流电源后,注意观察电流表的指针是否偏转,以及小烧杯内发生的现象,并用湿润的碘化钾淀粉试纸检验阳极放出的气体。
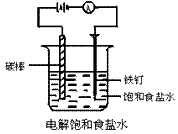
注:粗铁钉要与直流电源的阴极相连,碳棒与阳极相连。
用玻璃棒沾湿润的KI淀粉试纸检验阳极气体。
(1)饱和食盐水电解时,电流表指针发生偏转,阴、阳极均有气体放出,阳极气体有刺激性气味,并能使湿润的KI淀粉试纸变蓝,且阴极区溶液变红。
(2) 阳极:2Cl--2e-==Cl2↑
阴极:2H++2e-==H2↑(或2H2O+2e-==2OH-+H2↑)
总反应式:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑ (3)阴极区溶液变红的原因:这是由于饱和食盐水中,水所电离出的H+在阴极放电,破坏了水的电离平衡
(H2O
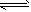 H++OH-)致使阴极区附近溶液中的OH-相对较多,溶液呈碱性,故酚酞变红。
H++OH-)致使阴极区附近溶液中的OH-相对较多,溶液呈碱性,故酚酞变红。 (4)例用电解饱和食盐水溶液可制取氢气、氯气和烧碱。
1.离子交换膜法电解制碱的主要生产流程可以简单表示如下图所示:

电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙,精制食盐水时经常进行以下措施
(1)过滤海水
(2)加入过量氢氧化钠,去除钙、镁离子,过滤 Ca2++2OH-=Ca(OH)2(微溶) Mg2++2OH-=Mg(OH)2↓
(3)加入过量氯化钡,去除硫酸根离子,过滤 Ba2++SO42-=BaSO4↓
(4)加入过量碳酸钠,去除钙离子、过量钡离子,过滤 Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓
(5)加入适量盐酸,去除过量碳酸根离子 2H++CO32-=CO2↑+H2O
(6)加热驱除二氧化碳
(7)送入离子交换塔,进一步去除钙、镁离子
(8)电解 2NaCl+2H2O
 H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。 2.以氯碱工业为基础的化工生产
NaOH、Cl2和H2都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于各工业。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
由电解槽流出的阴极液中含有30%的NaOH,称为液碱,液碱经蒸发、结晶可以得到固碱。阴极区的另一产物湿氢气经冷却、洗涤、压缩后被送往氢气贮柜。阳极区产物湿氯气经冷却、干燥、净化、压缩后可得到液氯。
2NaOH+Cl2=NaCl+NaClO+H2O H2O+Cl2=HCl+HClO H2+Cl2=2HCl 2NaOH+CO2=Na2CO3(苏打)+H2O NaOH+CO2=NaHCO3(小苏打)
随着人们环境保护意识的增强,对以氯碱工业为基础的化工生产过程中所造成的污染及其产品对环境造成的影响越来越重视。
1.确定化工生产的最佳过程
确定化工生产反应原理与过程的一般方法:对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。
①分析产品的化学组成,据此确定生产产品的主要原料;
②分析产品与生产原料之间关键元素的性质,确定主要生产步骤;
③分析生产原料的性质.确定反应原理。
2.选择化工生产的最佳原料
选择原料首先要考虑化学反应原理,此外还要考虑厂址选择、原料供应、能源供应、工业用水供应、产品存储、产品运输、产品预处理成本、环境保护等。
3.控制最佳化学反应条件
控制反应条件是取得化工生产最佳综合效益的重要环节之一。控制反应条件要应用化学反应速率理论和化学平衡原理,结合具体化学反应的特点以及生产技术和设备条件、能源消耗等,控制最佳化学反应速率和反应物的平衡转化率。
4.科学治理工业“三废”
“三废”主要是指废气、废液和废渣。治理“三废” 首先要从设计生产工艺与选择原料做起,即从源头上解决问题;其次是把好排放关,对排出的“三废”的处理,要尽最大努力使其资源化,最低要求是无害化。
5.充分利用“废热”
通过热交换或其他方式利用化学反应所放出的热量。
硫代硫酸钠的工业制法:
(1)亚硫酸钠
将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得硫代硫酸钠。
Na2CO3+SO2==Na2SO3+CO2 Na2SO3+S+5H2O==Na2S2O3·5H2O
(2)硫化碱法
利用硫化碱蒸发残渣、硫化钡废水中的碳酸钠和硫化钠与硫磺废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2
(3)氧化、亚硫酸钠和重结晶法
由含硫化钠、亚硫酸钠和烧碱的液体经加硫、氧化;亚硫酸氢钠经加硫及粗制硫代硫酸钠重结晶三者所得硫代硫酸钠混合、浓缩、结晶,制得硫代硫酸钠。
2Na2S+2S+3O2==2Na2S2O3 Na2SO3+S==Na2S2O3
(4)重结晶法
将粗制硫代硫酸钠晶体溶解(或用粗制硫代硫酸钠溶液),经除杂,浓缩、结晶,制得硫代硫酸钠。
砷碱法净化气体副产 利用焦炉煤气砷碱法脱硫过程中的下脚(含Na2S2O3),经吸滤、浓缩、结晶后,制得硫代硫酸钠。
高锰酸钾的工业制法:
工业上利用二氧化锰制备高锰酸钾,其步骤是
(1)二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2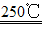 2K2MnO4+2H2O
2K2MnO4+2H2O
(2)电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH
2KMnO4+H2↑+2KOH
高锰酸钾常见的制备方法有以下两矿石中取得的二氧化锰和氢氧化钾在空气中或混合硝酸钾(提供氧气)加热,产生锰酸钾,再于碱性溶液中与氧化剂进行电解氧化得到高锰酸钾。 2MnO2+4KOH+O2→2K2MnO4+2H2O 2K2MnO4+Cl2→2KMnO4+2KCl
也可以用MnSO4在酸性环境中和二氧化铅(PbO2)或铋酸钠(NaBiO3)等强氧化剂反应产生。此反应也用于检验二价锰离子的存在,因为高锰酸钾的颜色明显种:
①法一:以MnO2(软锰矿)为原料制KMnO4
第一步:Mn(IV)→Mn(VI) 2MnO2+4KOH+O2====2K2MnO4+2H2O
第二步:CO2歧化K2MnO4 K2MnO4+2CO2====2KMnO4+MnO2+2K2CO3
这种制备方法的最高产率为66.7% 法
②电解法:阳极:2MnO42--2e-→2MnO4- 阴极:2H2O+2e-→H2↑+2OH- 总电解反应方程式为2K2MnO4+2H2O→2KMnO4+2KOH+H2↑
理论产率可达100%
纯硅的制取:
工业上在电炉内,用硅石和碳反应得粗硅和一氧化碳,然后用粗硅和氯气反应得四氯化硅,再用四氯化硅和氢气反应的纯硅和氯化氢,这样就完成硅的制造。(第一步完全相同,第二部有三种方法,工业上用的的是西门子的方法,其他两种不常见。)反应方程式
(1)石英制硅(冶金级),这一步是粗硅制取硅商业上是由高纯度的石英砂和木头,焦炭和煤使用碳棒电极在电弧炉中制得。在高于1900°C的温度下,依照下列方程式碳把石英砂还原成硅: SiO2+C→Si+CO2. SiO2+2C→Si+2CO. 这一过程所的硅称为冶金级硅。纯度为98%-99%。另外,硅制备办法还有熔盐电解法,即电解熔解的二氧化硅。
(2)高纯硅的制备在制备高纯硅之前,需要把粗硅转化成三氯化氢硅(300°C): Si+3HCl→HSiCl3+H2 接着,通过精馏使SiHCl3与其它氯化物分离,经过精馏的SiHCl3,其杂质水平可低于10-10%的电子级硅要求。然后,提纯后的SiHCl3通过CVD原理在1150°C下制备出多晶硅粉。2HSiCl3→Si+2HCl+SiCl4.
与“海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和金...”考查相似的试题有:
- 下列溶液能与镁反应生成氢气的是[ ]A.氯化铵溶液B.氢氧化钠溶液C.碳酸钾溶液D.饱和石灰水
- Al(OH)3和Mg(OH)2的分解温度是200~300℃和340~ 490℃,与聚乙烯的分解温度比较接近,将上述两种氢氧化物添加于聚乙烯制品中可...
- 下列有关金属的说法中,不正确的是[ ]A.钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来B.镁燃烧发出耀眼的白光...
- 下图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:(1)若X、Y都是惰性石墨电极...
- 氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如图所示,完成下列填空(1)在电解过程中,与电源负极相连的电极上的电极反应式为...
- 锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、C...
- 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2...
- 【三选一—选修化学与技术】二氧化氯(ClO2)被称作第四代杀菌消毒剂。工业上用NaCl 还原NaClO3生产ClO2的工艺流程如图所示:(1)...
- 工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下Ⅰ、碳酸钠的饱和溶液在不同温...
- 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下(1)焙烧炉中发生...