本试题 “亚氯酸钠(NaClO2)是一种重要的化工原料,以下是过氧化氢法生产亚氯酸钠的工艺流程图:已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3...” 主要考查您对二氧化氯
氯的其他化合物(高氯酸、氯化物、氯酸盐,盐酸等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化氯
- 氯的其他化合物(高氯酸、氯化物、氯酸盐,盐酸等)
二氧化氯:
二氧化氯有与氯气相似的刺激性气味,具有强烈刺激性,接触后主要引起眼和呼吸道刺激,吸入高浓度可发生肺水肿,能致死,对呼吸道产生严重损伤,高浓度的本品气体,可能对皮肤有刺激性。皮肤接触或摄入本品的高浓度溶液,可能引起强烈刺激和腐蚀,长期接触可导致慢性支气管炎。
二氧化氯的物理性质和化学性质:
(1)物理性质:二氧化氯(ClO2)是一种棕红色气体,浓度低是黄绿色气体,相对空气比重为1.1,比空气重,液体比重2.37,具有与氯相似的刺激性气味,浓度极低时,具有青草气味及轻微的甜味,沸点11℃凝固点-59℃,易溶于水和冰醋酸、四氯化碳等溶剂,液化二氧化氯及高浓度二氧化氯极不稳定,撞击或日光照射均会发生爆炸,在空气中,浓度超过10%就可能发生爆炸,低于10%则是稳定性极好的物质,没有爆炸的危险。
(2)化学性质:二氧化氯易溶于水,深解度是氯气的5倍,在室温30mm/Hg分压下,溶解度为2.9g/L;在室温760mm/Hg压力(常压),溶解度为3.1g/L,二氧化氯不易被水解,在水中以分子的形成存在,在低浓度下,(10mg/L以下)它杀茵、消毒能力,主要以氧化的方式进行,与氯气杀茵消毒不同,氯气消毒以电子转移的方式进行,因此ClO2杀茵可在pH值较大范围内(2-10)高效杀菌消毒,且对人体绝无害处,经检测水中ClO2在1mg/L浓度以下时对比1mg/L氯气的杀茵能力超过10倍以上,(在各种介质下,对应杀灭的时间,残菌数量,对照得出的结论)。与现有ClO2杀茵能力按有效氯大于ClO2的2.6倍的数据有出入。
影响ClO2的杀菌能力的因素:
对它不良影响的是:Cl2或对应的ClO-离子,ClO2-、ClO3-
对它产生促进作用的是:溶解氧 H2O2,ClO2+离子,Cl-
对它没有影响的是:CO32-、Na+、Ca2+等离子
氯的氧化物:
a.Cl2O是黄棕色气体,在有还原剂或加热时会发生爆炸,溶于水生成次氯酸,是次氯酸的酸酐。
b.ClO2是红黄色气体,冷凝时为红棕色液体,易发生爆炸。大量制取的方法为:2NaClO3+SO2== 2ClO2+Na2SO4。ClO2与碱作用生成亚氯酸盐和氯酸盐:2ClO2+2NaOH==NaClO2+NaClO3+H2O。
c.Cl2O7是无色油状液体,受热或撞击立即爆炸。
氯的含氧酸及其盐的性质变化规律:
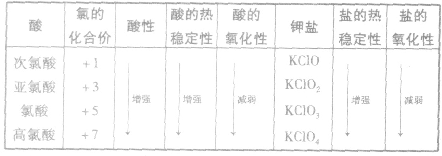
常见的氯化物:
(1)高氯酸:高氯酸HClO4,无色透明的发烟液体,在无机酸中酸性最强。可助燃,具强腐蚀性、强刺激性,可致人体灼伤。与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸的危险。在室温下分解,加热则爆炸。
(2)氯化物:如氯化钠、氯化钙等,Cl-+Ag+==AgCl↓
(3)次氯酸盐:次氯酸盐是次氯酸的盐,含有次氯酸根离子ClO-,其中氯的氧化态为+1。次氯酸盐常以溶液态存在,不稳定,会发生歧化反应生成氯酸盐和氯化物。见光分解为氯化物和氧气。次氯酸盐是一种常用的漂白剂和消毒剂。在人体组织中,在亚铁血红素的髓过氧化物酶的催化作用下,过氧化物与氯化物反应可产生ClO-或HClO。这种在血球内产生的ClO-/HClO或Cl2
(4)氯酸盐:如氯酸钾在二氧化锰催化下可制取氧气
(5)盐酸:盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。工业品浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形成盐酸小液滴分散在空气中形成酸雾。
(6)氯化氢:无色或微黄色易挥发性液体,有刺鼻的气味。易溶于水与氨气反应生成氯化铵HCl+NH3==NH4Cl
卤化氢和氢卤酸、卤化银及碘化物:
1.卤化氢物理性质:卤化氢均为无色有刺激性气味的气体,均极易溶于水,在空气中都易形成酸雾。化学性质:从HF—HCl—HBr—HI,稳定性逐渐减弱,HI受热易分解;还原性逐渐增强。
2.氢卤酸:Hx溶于水后形成的溶液即氢卤酸。在氢卤酸中,除氢氟酸是弱酸外,其余皆为强酸。从氢氟酸一氢碘酸,酸性逐渐增强,还原性也逐渐增强,其中氢碘酸在空气中易被氧气氧化。
3.卤化银:

4.碘化物碘是人体必需的微量元素之一,又称“智慧元素”。人体缺碘会导致碘缺乏病(IDD),从而损害人的智力和健康。补碘最经济、方便有效的方法是食用含碘食盐。含碘食盐中加的是碘酸钾。值得注意的是,人体摄入过多的碘也是有害的,不能认为高碘的食物吃得越多越好,要根据个人的身体情况而定。
卤素单质及其化合物的特殊性:
(1)Br2是常温下唯一呈液态的非金属单质,易挥发,蒸气有毒。保存液溴要采用水封法。
(2)碘单质易升华,AgI可用于人工降雨,碘盐可用于防治甲状腺肿大。
(3)HClO4是常见含氧酸中酸性最强的酸,HClO 是氯的含氧酸中氧化性最强的酸。
(4)在卤素中,氯、溴、碘均有多种价态,但氟只有-1价和0价,而无正价。
(5)卤素单质一般不与稀有气体反应,但F,却能与Xe、Kr等稀有气体反应生成相应的氟化物。如 KrF2、XeF2、:XeF4、XeF6等。
(6)Cl2、Br2、I2的实验室制法均可用MnO2与相应的浓的氢卤酸反应制得,但F2不能用上述方法在实验室制得。
(7)卤素单质与水反应,其中Cl2、Br2、I2在反应中既是氧化剂又是还原剂,而F2与水作用时,只作氧化剂。
(8)卤素单质都能与强碱溶液反应,一般可表示为 X2+2OH-==X-+XO-+H2O(F、I除外)。
(9)碘单质遇淀粉呈现特殊蓝色。可用来鉴别碘单质或淀粉。
(10)I2在水中的溶解度很小,若在水中加入少量的KI,碘的溶解度却明显增大,这是因为发生了反应I2 +I-==I3-
(11)卤素单质与Fe作用时,除Fe+I2==FeI2 外,其他均生成+3价铁盐。常温下,干燥的液氯不与 Fe作用,故工业上可用钢瓶盛液氯。
(12)随着相对分子质量的增大,HCl、HBr、HI的熔、沸点逐渐升高。HF的相对分子质量虽比HCl小,其熔、沸点却比HCl高,是因为HF分子间存在氢键。
(13)在氧卤酸中,只有氢氟酸能与玻璃反应:SiO2 +4HF==SiF4↑+2H2O,在实验室制取HF必须在铅皿中进行。
(14)实验室制取HF、HCl分别用CaF2、NaCl与浓硫酸反应,但实验室制取HBr、HI宜用NaBr和KI与浓磷酸反应。因为生成的HBr、HI易被浓硫酸氧化生成Br2或I2。
(15)在卤化银中,AgCl、AgBr、AgI均难溶于水,且见光易分解,但AgF却易溶于水且见光不分解。
与“亚氯酸钠(NaClO2)是一种重要的化工原料,以下是过氧化氢法生...”考查相似的试题有:
- 二氧化氯是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,不但具有更显著地杀菌能力,而且不会产生对人体有潜在...
- (6分)将10g NaCl和NaI的混合物溶于水后,通入足量的Cl2,将溶液蒸干灼烧得固体6.34g. 求原混合物中NaCl的质量分数。
- 某课外活动小组拟用下列实验装置探究氯气与氨气之间的反应。其中A、B分别为氨气和氯气的发生装置;C为纯净、干燥的氯气与氨气...
- 下列说法正确的是( )A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色B.漂白粉的有效成分是CaCl2和Ca(ClO)2,应...
- 把6.1g干燥纯净的氯酸钾和二氧化锰的混合物放在试管里加热,当完全分解、冷却后称得剩余固体质量为4.2g,求原混合物里氯酸钾...
- 下列叙述中正确的是( )A.碘易升华,所以要保存在铁盖旋紧的试剂瓶中B.液溴应保存在磨口玻璃塞棕色试剂瓶中,并加少量水进...
- 体积为1L的干燥烧瓶中用排气法收集HCl后,测得瓶中的气体对氢气的相对密度为16.25(同温同压),将此烧瓶倒置于水中做喷泉实验...
- (14分)瑞典化学家舍勒在研究软锰矿(主要成分是)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——...
- 将20 mL 10 mol·L-1的浓盐酸滴入盛有足量MnO2粉末的烧瓶中并加热,若不考虑HCl的挥发,则被氧化的氯化氢的物质的量是( )A.小...
- 下列叙述中能证明次氯酸是一种弱酸的是A.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸B.次氯酸是一种强氧化剂C.次氯酸能使染料...