本试题 “下列判断正确的是[ ]A.酸酐一定是氧化物B.分子晶体中一定存在化学键C.碱性氧化物一定是金属氧化物D.正四面体分子中键角一定是109°28′” 主要考查您对物质的简单分类
无机分子的立体结构
分子晶体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的简单分类
- 无机分子的立体结构
- 分子晶体
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
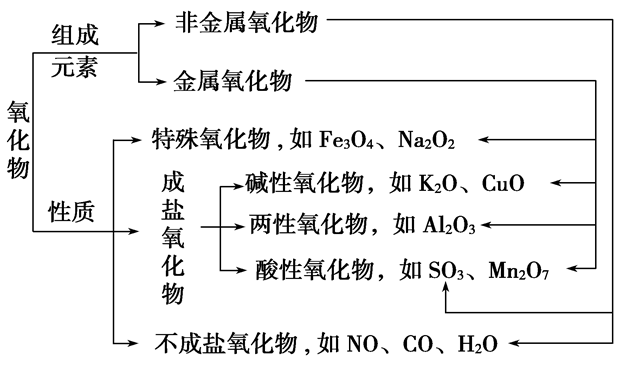
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:

氧化物的分类:
分子中原子的空间关系是分子表现出不同的空间构型。
用价层电子对互斥理论确定分子或离子的VSEPR模型和立体构型的方法:
首先计算分子或离子中的中心原子的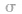 键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
1.价层电子对数的确定方法
(1) 键电子对数:由分子式确定,中心原子形成的
键电子对数:由分子式确定,中心原子形成的 键的数目就是
键的数目就是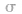 键电子对数。如
键电子对数。如 分子中的中心原子
分子中的中心原子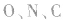 分别有2、3、4对
分别有2、3、4对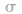 键电子对。
键电子对。
(2)孤电子对数
①分子中的中心原子上的孤电子对数
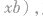 式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
以 为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则
为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则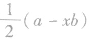 分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
②对于阳离子,a为中心原子的价电子数减去离子的电荷数;对于阴离子,a为中心原子的价电子数加上离子的电荷数(绝对值)。x和b的计算方法及计算公式[中心原子上的孤电子对数= ]均不变。
]均不变。
2.确定分子(或离子)的VSEPR模型
根据价层电子对数和价层电子对的相互排斥,可得出分子或离子的VSEPR模型,其关系如下表。 
3.确定分子(或离子)的立体构型略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型,如上表。
(1)分子或离子中的价层电子对数分别为2、3、4,则其VSEPR模型分别为直线形、平面三角形、正四面体形或四面体形。如果价层电子对数为5,则为三角双锥形;如果为6,则为正八面体形或八面体形。
(2)如果中心原子的孤电子对数为0,则VSEPR模型(及名称)和分子或离子的立体构型(及名称)是一致的;若孤电子对数不为0,则二者不一致。
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 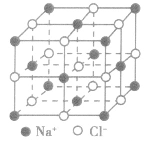 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 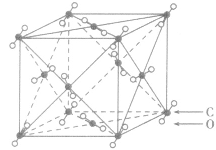 |
| 金刚石晶体 |  |
| SiO2晶体 | 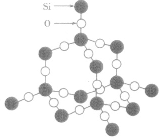 |
| 石墨晶体 (混合晶体) | 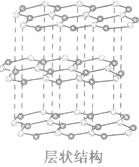 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
与“下列判断正确的是[ ]A.酸酐一定是氧化物B.分子晶体中一定存...”考查相似的试题有:
- 下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是 纯净物混合物强电解质弱电解质非电解质A盐酸醋酸碳酸氨...
- 物质经鉴定只含有一种元素,下列说法正确的是( )A.肯定是纯净物B.可能是混合物C.肯定是某一种单质D.一定是一种稀有气体
- 下列物质中,一定由三种元素组成的是[ ]A.酸B.碱C.盐D.氧化物
- Na2CO3俗名纯碱,下面是对纯碱采用不同的分类法进行分类,其中正确的是A.Na2CO3是碱B.Na2CO3是盐C.Na2CO3是钠盐D.Na2CO3...
- 某同学将浓硫酸、NaOH固体、碱石灰、P2O5固体等物质划分为一类.该同学的分类依据为( )A.酸类B.碱类C.干燥剂D.氧化物
- 若N60与C60结构相似的另一种“足球分子”,则下列说法正确的是( )A.N60分子中只含有共价键B.N60和14N都是氮的同位素C.N60...
- (12分)现有下列9种物质:碳酸钠、氧化铁、二氧化硫、铜、氯气、氢氧化钾、硫酸、一氧化碳、硝酸铝,请将上述物质按要求完成下...
- 中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂...
- 下列分子中所有原子都满足最外层8电子结构的是( )A.二氟化氙B.三氯化磷C.六氟化硫D.三氟化硼
- 下列说法中正确的是( )A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构B.P4和CH4都是正...