本试题 “工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的...” 主要考查您对测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
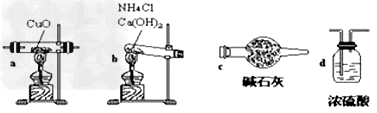
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
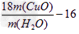
发现相似题
与“工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯...”考查相似的试题有:
- 铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4•5H2O呈蓝色等.研究性学习小组甲为检测实验室的Cu...
- 有一包白色固体粉末,其中可能含有KCl、BaCl2、Cu(NO3)2、K2CO3中的一种或几种,现做以下实验:①将部分粉末加入水中,振荡...
- 有三种可溶性盐A、B、C,可能由下列离子组成:Na+、Fe2+、Al3+、Cu2+、ClO-、SO42-、CO32-、NO3-、Cl-.(1)A的溶液为浅绿色...
- 某同学设计如下实验测量m g铜银合金样品中铜的质量分数:下列说法中不正确的是( )A.收集到的V L气体为 NO、NO2B.过滤用到...
- I.实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成.取w g该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.现用图示...
- 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报...
- 有一固体样品,其中只含有Na2CO3·10H2O和NaHCO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个...
- 化学兴趣小组发现,往CuSO4溶液中加入一定浓度的Na2CO3溶液得到的蓝色沉淀,若加入NaOH溶液则得到浅绿色沉淀.为此,小组同学...
- 实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧气中充分燃烧,生成CO2、H2O和N2。现用下图所...
- 据下图提供的仪器装置,完成提纯并测定Na2CO3样品的纯度(其中含NaHCO3杂质)。请回答下列问题:实验一测定Na2CO3样品中NaHCO...