本试题 “某纯碱厂技术科的人员对该厂纯碱样品的质量进行检验.其中能够说明纯碱样品中可能含有杂质(NaHCO3)的实验是[ ]①样品溶于水,并加入足量的澄清石灰水,变浑浊...” 主要考查您对碳酸氢钠
其他物质的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳酸氢钠
- 其他物质的检验
碳酸氢钠(NaHCO3):
(1)俗名:小苏打;细小白色晶体,溶解度小于Na2CO3,受热易分解,可用于治疗胃酸过多、发酵剂
(2)与H+反应:HCO3-+H+==CO2↑+H2O
(3)与NaOH反应:HCO3-+OH-==CO32-+H2O
(4)与石灰水反应:生成CaCO3沉淀
(5)与BaCl2和CO2不反应
碳酸氢钠的物理性质:
碳酸氢钠为白色晶体,或不透明单斜晶系细微结晶。比重2.15g。无臭、味咸,可溶于水,不溶于乙醇。其水溶液因水解而呈微碱性,常温中性质稳定,受热易分解,在50℃以上迅速分解,在270℃时完全失去二氧化碳,在干燥空气中无变化,在潮湿空气中缓慢分解。溶解度:7.8g,18℃;16.0g,60℃。
碳酸氢钠的用途:
碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
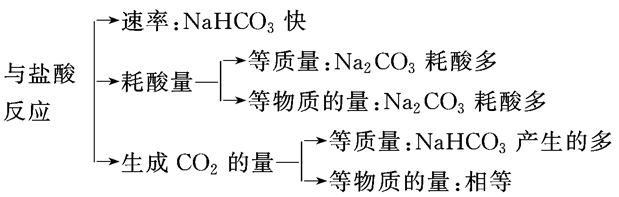
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。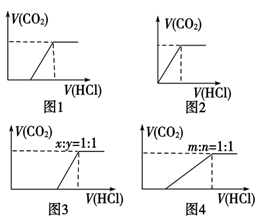
其他物质的检验:
1.有机物的检验
(1)在有机物检验时,需特别知道的物质性质:
①溶解性:有机物均能溶于有机溶剂,能溶于水的有机物为:低级醇、醛、酸。
②密度:比水小:烃、苯及同系物、酯、油脂;比水大:CCl4、溴苯、硝基苯。
③有毒:苯、硝基苯、甲醇、甲醛。
(2)常见有机物或官能团的检验

2.卤代烃中卤元素的检验:与氢氧化钠加热反应后取上层反应完全的清夜,再加入稀硝酸酸化的硝酸银溶液,观察沉淀颜色,白色的是氯离子,淡黄色的是溴离子,黄色的是碘离子
3.淀粉水解产物的检验:用稀硫酸作为催化剂,水解后先加NaOH来中和硫酸酸性,然后再分出一部分加足量碘酒,若变蓝,则仍含有淀粉,未完全水解;反之则已经完全水解;另一部分加土伦试剂或者菲林试剂,检验葡萄糖,若有银镜生成,或者有砖红色沉淀生成,则说明含有还原糖,水解已经发生,反之则没有发生水解。
1.有机物的检验
(1)在有机物检验时,需特别知道的物质性质:
①溶解性:有机物均能溶于有机溶剂,能溶于水的有机物为:低级醇、醛、酸。
②密度:比水小:烃、苯及同系物、酯、油脂;比水大:CCl4、溴苯、硝基苯。
③有毒:苯、硝基苯、甲醇、甲醛。
(2)常见有机物或官能团的检验

2.卤代烃中卤元素的检验:与氢氧化钠加热反应后取上层反应完全的清夜,再加入稀硝酸酸化的硝酸银溶液,观察沉淀颜色,白色的是氯离子,淡黄色的是溴离子,黄色的是碘离子
3.淀粉水解产物的检验:用稀硫酸作为催化剂,水解后先加NaOH来中和硫酸酸性,然后再分出一部分加足量碘酒,若变蓝,则仍含有淀粉,未完全水解;反之则已经完全水解;另一部分加土伦试剂或者菲林试剂,检验葡萄糖,若有银镜生成,或者有砖红色沉淀生成,则说明含有还原糖,水解已经发生,反之则没有发生水解。
发现相似题
与“某纯碱厂技术科的人员对该厂纯碱样品的质量进行检验.其中能...”考查相似的试题有:
- 甲试管中盛有0.5mol/L Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴...
- 在四种化合物①NaHCO3、②Al(OH)3、③Al2O3、④H2N-CH2-COOH中,跟盐酸和氢氧化钠溶液都能反应的是[ ]A.只有② ④B.只有①②C.只有...
- 有两瓶失去标签的物质的量浓度相同的Na2CO3和NaHCO3稀溶液.下列鉴别方法和所得到的结论不正确的是[ ]A.取少量未知溶液,分...
- 某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2...
- 化学美表现在很多方面,化学物质的美丽颜色就是其中一个重要的方面。下列物质中,有一种物质的颜色与其他三种的颜色不同,这...
- 1 mol过氧化钠与2 mol碳酸氢钠固体混合物,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是[ ]A.Na2CO3B....
- 下列装置所示的实验能达到实验目的是( )A.分离碘酒中的碘和酒精B.分离沸点不同的两种互溶液体C.验证NH3的溶解性D.比较N...
- A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示请回答下列问题:(1)A与水反...
- 在试管中加入10%的氢氧化钠溶液1mL,然后滴入2%的硫酸铜溶液2-3滴,稍加振荡,加入某病人的尿液,在酒精灯火焰上加热至沸腾,...
- 下列有关实验的说法中错误的是[ ]A.向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去,并不能证...