本试题 “二氧化硫(SO2)是形成酸雨的因素之一,它的含量是空气质量监测的一个重要指标。某兴趣小组同学取到热电厂(燃煤电厂)附近的刚下的雨水进行实验。①测得该雨水...” 主要考查您对二氧化硫
大气污染、改善大气质量
金属、非金属的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硫
- 大气污染、改善大气质量
- 金属、非金属的有关计算
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液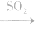 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


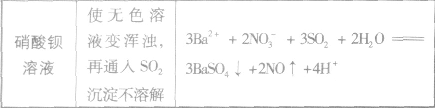
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表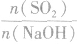 ,如下数轴所示:
,如下数轴所示: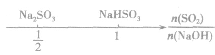
分析数轴可得:
(1)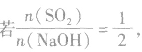 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)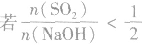 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)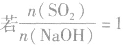 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)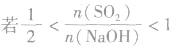 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)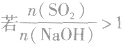 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

(1)大气污染源:颗粒物、硫的氧化物、氮的氧化物、CO 碳氢化合物、氟氯代烷
(2)大气污染危害:危害人体健康、影响动植物的生长、严重时会影响地球的气候
(3)全球性三大环境问题:酸雨、臭氧层受损、温室效应
①酸雨:正常雨水:PH约为5.6 酸雨:PH小于5.6 我国为硫酸型酸雨,烧煤炭造成
硫酸型:硫的氧化物转化 SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 大气中烟尘和O3作催化剂
硝酸型:氮的氧化物转化 3NO2+H2O=2HNO3+NO↑
②臭氧层:自然界的臭氧90%集中在距地面15-50km的大气平流层中 吸收自太阳的大部分紫外线
引起臭氧层受损物质 氟氯代烷(致冷剂)、哈龙(含溴的灭火剂)、CCl4、N2O、NO、核弹爆炸产物
保护臭氧层公约:《保护臭氧层维也纳公约》 《关于消耗臭氧层物质的蒙特利尔议定书公约》
③温室效应:太阳短波辐射可以透过大气射入地面,而地面增暖后放出的长短辐射却被大气中的二氧化碳等物质所吸收,从而产生大气变暖的效应
温室效应后果:荒漠将扩大,土地侵蚀加重,森林退向极地,旱涝灾害严重,雨量将增加7-11%;温带冬天更湿,夏天更旱;热带也将变得更湿,干热的副热带变得更干旱,两极冰块将熔化,使海平面上升1米多,引起厄尔尼诺现象
引起温室效应的物质:CO2、CH4、N2O、氟氯代烷
改善大气质量:
①减少煤等化石燃料燃烧产生污染:改善燃煤质量、改进燃烧装置、技术和排烟设备、发展洁净煤技术和综合利用、调整和优化能源结构
煤的综合利用: 煤的的干馏、煤的气化、煤的液化
煤的气化 C+H2O(g)=CO+H2
煤的液化 CO+2H2→CH3OH
煤的脱硫 2CaCO3+O2+2SO2=2CaSO4+2CO2
②减少汽车等机动车尾气污染
尾气污染(占大气污染排出总量的40-50%):CO、NO2、NO、碳氢化合物
使用无铅汽油:四乙基铅作抗爆震剂,铅对神经系统损害大
尾气系统加催化转化器:前半部 2CO+2NO2
 CO2+N2 后半部 2CO+O2
CO2+N2 后半部 2CO+O2 2CO2 C7H16+11O2
2CO2 C7H16+11O2 7CO2+8H2O
7CO2+8H2O包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: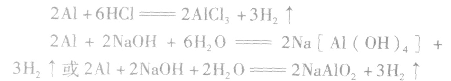
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为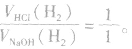
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为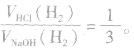
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为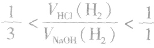 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: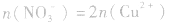
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
与“二氧化硫(SO2)是形成酸雨的因素之一,它的含量是空气质量监测...”考查相似的试题有:
- 已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见的化合物。上述各物质间的相互关...
- 只存在于溶液中的酸是( )A.HClB.H2SO3C.H2SO4D.H3PO4
- W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。(1)W、X各自的最高价氧化物对应的水化...
- 室内空气污染的主要来源之一是泡沫绝缘塑料、化纤地毯、书报、油漆等不同程度释放出的气体,该气体是A.甲烷B.甲醛C.一氧化...
- 节能减排是指节约能源和减少环境有害物排放。国家“十二五规划”明确提出了节能减排的目标,即到2015年,单位GDP二氧化碳排放降...
- 保护环境是每一个公民的责任,下列做法有利于保护环境的是[ ]①推广使用无磷洗涤剂 ②城市生活垃圾分类处理 ③推广使用一次性木...
- 2006年4月,北京等北方各大城市遭遇很强大的沙尘暴袭击,导致北京等“满城尽带黄金甲”,空气污染为五级重度污染。你认为该城市...
- 对某次采集的酸雨样品,每隔一段时间测定一次pH, 得到数据如下:回答:(1)放置时,雨水样品pH变化的主要原因_______________...
- (5 分)膳食合理有利于人体健康,应用所学化学知识解决问题。(1)下列食品中富含蛋白质的是(填序号,同下) 。①绿豆 ②苹果...
- wg铁粉和铝粉的混合物,与过量的NaOH溶液反应,然后过滤,将沉淀放在蒸发皿中加热,充分反应后, 所得固体物质的质量仍为wg。...