本试题 “根据相关的原理,下列判断正确的是[ ]A.由于水中存在氢键,所以稳定性:H2O>H2SB.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2C.等物...” 主要考查您对范德华力
氢键
粒子浓度大小的比较
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 范德华力
- 氢键
- 粒子浓度大小的比较
范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。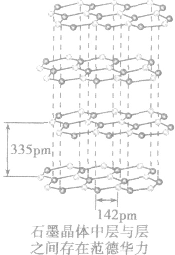
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点: 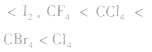 |
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O 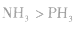 |
氢键:
(1)概念:已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。如水分子问的氢键如下图所示。 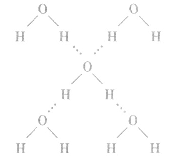
(2)表示方法:A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。
(3)分类
(4)属性:氢键不属于化学键,它属于一一种较强的分子间作用力,其作用能大小介于范德华力和化学键之间。
(5)对物质性质的影响
①氢键对物质熔、沸点的影响。分子问存在氧键时,破坏分子问的氢键,需要消耗更多的能量,所以存在氢键的物质具有较高的熔点和沸点。
例如:氮族、氧族、卤素中的N、O、F的氧化物的熔、沸点的反常现象。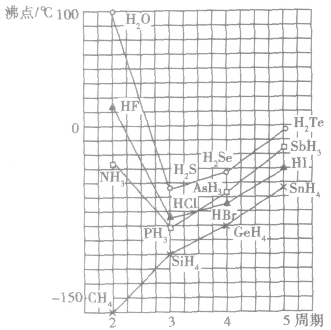
②氢键对物质溶解度的影响:氢键的存在使物质的溶解性增大。例如:NH3极易溶解于水,主要是由于氨分子和水分子之问形成了氢键,彼此互相缔合,因而加大了溶解。再如乙醇、低级醛易溶于水,也是因为它们能与水分子形成氢键。
③氢键的存在会引起密度的变化。水结冰时体积膨胀、密度减小的反常现象也可用氢键解释:在水蒸气中水以单个的水分子形式存在;在液态水中,通常是几个水分子通过氢键结合,形成(H2O)n小集团;在固态水(冰)中,水分子大范围地以氢键互相连接,成为疏松的晶体,因此在冰的结构中有许多空隙,造成体积膨胀,密度减小。
④分子内氢键与分子间氢键对物质性质的不同影响:氢键既可以存在于分子内部的原子之间,也可以存在于分子间的原子之间,只不过这两种情况对物质性质的影响程度是不一样的。例如,邻羟基苯甲醛存在分子内氢键: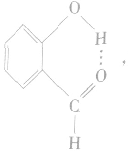 熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键:
熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键: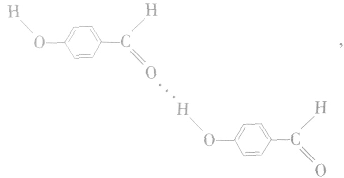 熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
6)存在:水、醇、羧酸、酰胺、氨基酸、蛋白质、结晶水合物等物质中都能存在;生命体中许多大分子内也存在氢键,如氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也是以氢键相互结合的。
离子浓度大小比较方法:
(1)考虑水解因素:如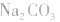 溶液
溶液 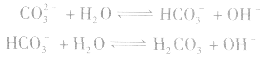
所以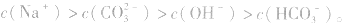
(2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的
 三种溶液中,
三种溶液中, 由大到小的顺序是c>a>b。
由大到小的顺序是c>a>b。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素。如相同浓度的 的混合液中,离子浓度顺序为:
的混合液中,离子浓度顺序为: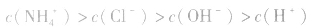
 的电离程度大于
的电离程度大于 的水解程度。
的水解程度。
盐溶液的“三大守恒”:
①电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:
推出: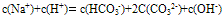
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nc(Na+):nc(C)=1:1,
推出: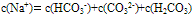
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系: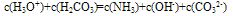
(2)粒子浓度大小比较的方法:
①单一溶液中离子浓度大小的比较
A. 一元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
如:在CH3COONa溶液中各离子浓度大小关系: 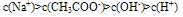
B. 二元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)> c(二级水解离子)>c(水电离出的另一离子)
如:Na2CO3溶液中离子浓度的关系: 
②比较不同电解质溶液中同一种粒子浓度的大小。应注意弱酸、弱碱电离程度的大小以及影响电离度的因素,盐类水解及水解程度对该粒子浓度的影响。
③比较经过反应化学反应后离子浓度的大小:
A. 确定电解质溶液的成分
B. 确定溶液中含哪些粒子(分子、离子),此时要考虑物质的电离和水解情况
C. 确定各种粒子的浓度或物质的量的大小
D. 根据题目要求做出判断
注:要抓住“两小”。即弱电解质电离程度小,故未电离的弱电解质分子数远多于已电离出离子数目;盐的水解程度小,故未水解的粒子数目远多于水解生成的粒子数目
与“根据相关的原理,下列判断正确的是[ ]A.由于水中存在氢键,...”考查相似的试题有:
- 范德华力为akJ/mol,化学键为bkJ/mol,氢键为ckJ/mol,则a、b、c的大小关系是[ ]A.a>b>cB.b>a>cC.c>b>aD.b>c>a
- 共价键、离子键和分子间作用力是物质间的不同作用力,下述物质中只含上述一种作用力的是( )A.干冰B.氯化钠C.氢氧化钠D.碘
- 下列物质变化的现象,不能通过分子间作用力来解释的是[ ]A.HF、H2O的沸点比HCl、H2S的沸点高很多B.正戊烷的沸点比新戊烷的...
- 关于浓度均为0.1 mol/L的三种溶液: ①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是[ ]A.c(NH4+):③>①B.水电离出的c(H+)...
- A、D、E、X、Y五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,D元素的最高价氧化物对应的水化物与其...
- 北京奥运会"祥云火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。(1)丙烷脱氢可得丙烯。已知:C3H8(g)==CH...
- 下列溶液中微粒的物质的量浓度关系正确的是[ ]A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)...
- 有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成(忽略体积的变化):①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与...
- 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是...
- 常温下将一定浓度的某一元酸HA和0.1 mol/LNaOH溶液等体积混合后,下列说法正确的是[ ]A.若pH=7,HA的浓度一定为0.1 mol/LB....