本试题 “已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中...” 主要考查您对强电解质电离(氯化钠、硫酸氢钠等物质的电离)
水的电离平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强电解质电离(氯化钠、硫酸氢钠等物质的电离)
- 水的电离平衡
强电解质电离:
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
酸与碱反应的几种情况:
1.等体积、等物质的量浓度的酸 混合
混合 
2.等体积的酸 混合
混合 
3.若酸 等体积混合溶液呈中性
等体积混合溶液呈中性 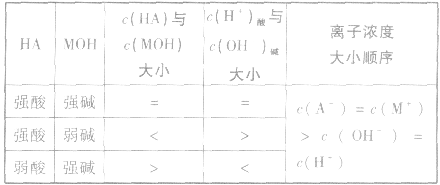
4.强酸溶液(pH=a)与强碱溶液(pH=b)完全中和时的体积比

水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
发现相似题
与“已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温...”考查相似的试题有:
- 已知0.5L盐酸和硫酸的混合溶液中含有0.1mol Cl-和0.2mol SO42-,则此溶液中H+的物质的量浓度是( )A.1 mol/LB.0.5 mol/LC...
- 常温下,有关醋酸溶液的叙述中错误的是(双选) ( )。A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)
- 室温时,将一定量的醋酸和氢氧化钠溶液混合,充分反应后,对于所得溶液的叙述一定正确的是A.若pH < 7 ,则c (CH3COO-)>c(N...
- 将pH=4的酸溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是.(1) 等于7 (.2) 大于7 (3) 小于7 (4) . 无法确定A.(1)B.(4)...
- 25℃时,0.01mol/L的HCl溶液中,由水电离出的H+浓度是( )A.1×10-7mol•L-1B.1×10-12mol•L-1C.1×10-2mol•L-1D.1×10-14mol•L-1
- 常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )A.X、...
- 向pH=6的蒸馏水中加入一定量的稀H2SO4,保持温度不变,测得溶液的pH=2。下列关于该溶液的叙述错误的是[ ]A.该温度高于25℃B....
- 下列说法正确的是( )A.若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaBB.相同条件下,将pH=11的NaOH溶液和氨水分别稀...
- 25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后pH=7,则下列关系一定正确的是 ( )A.a=bB.a>bC.c (A-)= c(Na+)D.c ...
- 下列物质溶解于水中,能促进水的电离的是( )A.B.C.D.