本试题 “某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品。(1)查阅KNO3和NaCl的溶解度曲线,如图。从图中可得到的一条信息是______...” 主要考查您对溶液的配制
饱和溶液,不饱和溶液
溶液的定义、组成及特征
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶液的配制
- 饱和溶液,不饱和溶液
- 溶液的定义、组成及特征
知识梳理:
1 、固体 + 水
①实验步骤:计算—称量—量取—溶解
②实验器材:托盘天平 + 药匙(或镊子) ;合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、称量和量取都要准确,溶解时固体要溶解完全
2 、液体 + 水
①实验步骤:计算—量取—溶解
②实验器材:合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、量取都要准确,同时需要两种不同规格的量筒
配制溶液的步骤:
(1)用溶质和水配制一定溶质质量分数的溶液
①实验用品:托盘天平、烧杯、量筒、胶头滴管、玻璃棒、药匙等。
②实验步骤:
计算→称量药品→量取水→搅拌溶解
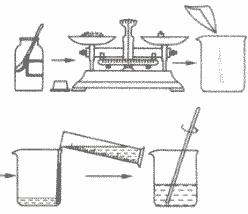
a.计算所需溶质和水的质量;
b.用托盘天平称量所需溶质,倒入烧杯中;
c.把水的密度近似看作1g/cm3,用量筒量取一定体积的水,倒入盛有溶质的烧杯里,用玻璃棒搅拌,使溶质溶解;
d.把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中。
③导致溶液质量分数变化的因素
a.称量时物质和砝码的位置放错,如止确称量5.8gNaCl,应在右盘放置5g砝码,再用0.8g游码,若放错位置,将砝码放在天平的左盘,则实际称量NaCl的质量为5g-0.8g=4.2g,这样会导致配制的溶液溶质质量分数变小;
b.量筒量取水的体积时读取示数错误,读取示数时仰视读数所量取水的实际体积大于理论值,将会使配制的溶液溶质质量分数变小;读取示数时俯视读数所量取水的实际体积小于理论值,将会使配制的溶液溶质质量分数变大;
c.将量筒中的水倒入烧杯时洒落到外面或未倒净,将导致溶液溶质质最分数偏大;
d.所用固体不纯,将会导致溶液溶质质量分数偏小;
e.计算错误可能会导致溶液溶质质量分数偏大或偏小。
配制溶液时导致溶质质量分数变化的原因:
在配制一定质量和一定质量分数的溶液过程中,经常会出现所得溶液溶质质量分数偏大或偏小的情况。
1. 所配溶液溶质质量分数偏小的原因:
①从计算错误角度考虑:水的质量算多了,溶质的质量算少了;
②从用托盘大平称量的角度考虑:天平读数有问题。药品和砝码放颠倒了,左盘放纸片但右盘没有放纸片,调零时,游码未拨回“0”刻度等;
③从用量筒量取液体的角度考虑:量取溶剂时,仰视读数了;
④从转移药品角度考虑:烧杯不干燥或烧杯内有水,量筒中的液体溶质未全部倒人烧杯中;
⑤从药品的纯度角度考虑:溶质中含有杂质
2. 所配溶液溶质质量分数偏大的原因
①称量时,所用砝码已生锈或沾有油污;②量取溶剂时,俯视读数了。
综合配制溶液的计算利用:
所提供的信息可选取多种方案配制所需的溶液。如现有KCl固体、蒸馏水、5%的KCl溶液、15%的KCl溶液,配制100g10%的KCl溶液,其方案有:
| 所需药品 | 主要步骤 | |
| 一 | 10gKCl+90g蒸馏水 | 用天平称量10gKCl,用量筒量取90ml水,分别倒入烧杯,用玻璃棒搅拌至KCl固体全部消失 |
| 二 | 66.7g15%的KCl溶液33.3g蒸馏水 | 用量筒量取33.3mL水,用天平称66.7g15%的KCl溶液,混合均匀即可 |
| 三 | 5.3gKCl+94.7g 5%的KCl溶液 | 用天平称量5.3gKCl固体和94.7g 5%的KCl溶液,将5.3gKCl倒入94.7g5%的KCl溶液中,用玻璃棒搅拌至KCl固体全部消失 |
| 四 | 50g5%KCl溶液+50g15%KCl 溶液 | 用天平称量5%、15%的KCl溶液各50g,混合均匀即可 |
饱和溶液和不饱和溶液的概念:
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液 不饱和溶液
不饱和溶液
(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水 不饱和石灰水
不饱和石灰水
概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)
溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液 饱和溶液
饱和溶液
溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)
溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液 不饱和溶液
不饱和溶液
溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
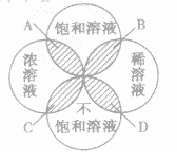 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液
 不饱和溶液
不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水
 不饱和石灰水
不饱和石灰水概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液
 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液
 饱和溶液
饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液
 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液
 不饱和溶液
不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
溶液的概念:
一种或几种物质分散到另一种物质中,形成均一的,稳定的混合物,叫做溶液
溶液的组成:
(1)溶液由溶剂和溶质组成溶质:被溶解的物质溶剂:
溶液质量=溶剂质量+溶质质量
溶液的体积≠溶质的体积+溶剂的体积
(2)溶质可以是固体(氯化钠、硝酸钾等)、液体(酒精、硫酸等)或气体(氯化氢、二氧化碳等),一种溶液中的溶质可以是一种或多种物质。水是最常用的溶剂,汽油、洒精等也可以作为溶剂,如汽油能够溶解油脂,洒精能够溶解碘等。
溶液的特征:
均一性:溶液中各部分的性质都一样;
稳定性:外界条件不变时,溶液长时间放置不会分层,也不会析出固体溶质
对溶液概念的理解:
溶液是一种或儿种物质分散到另一种物质里.形成的均一、稳定的混合物。应从以下几个方面理解:
(1)溶液属于混合物;
(2)溶液的特征是均一、稳定;
(3)溶液中的溶质可以同时有多种;
(4)溶液并不一定都是无色的,如CuSO4溶液为蓝色;
(5)均一、稳定的液体并不一定郡是溶液,如水;
(6)溶液不一定都是液态的,如空气。
溶液与液体
(1)溶液并不仅局限于液态,只要是分散质高度分散(以单个分子、原子或离子状态存在)的体系均称为溶液。如锡、铅的合金焊锡,有色玻璃等称为固态溶液。气态的混合物可称为气态溶液,如空气。我们通常指的溶液是最熟悉的液态溶液,如糖水、盐水等。
(2)液体是指物质的形态之一。如通常状况下水是液体,液体不一定是溶液。
3. 溶液中溶质、溶剂的判断
(1)根据名称。溶液的名称一般为溶质的名称后加溶剂,即溶质在前,溶剂在后。如食盐水中食盐是溶质,水是溶剂,碘酒中碘是溶质,酒精是溶剂。
(2)若是固体或气体与液体相互溶解成为溶液。一般习惯将固体或气体看作溶质,液体看作溶剂。
(3)若是由两种液体组成的溶液,一般习惯上把量最多的看作溶剂,量少的看作溶质。
(4)其他物质溶解于水形成溶液时。无论,水量的多少,水都是溶剂。
(5)一般水溶液中不指明溶剂,如硫酸铜溶液,就是硫酸铜的水溶液,蔗糖溶液就是蔗糖的水溶液,所以未指明溶剂的一般为水。
(6)物质在溶解时发生了化学变化,那么在形成的溶液中,溶质是反应后分散在溶液中的生成物。如 Na2O,SO3分别溶于水后发生化学反应,生成物是 NaOH和H2SO4,因此溶质是NaOH和H2SO4,而不是 Na2O和SO3;将足量锌粒溶于稀硫酸中所得到的溶液中,溶质是硫酸锌(ZnSO4),若将蓝矾(CuSO4·5H2O) 溶于水,溶质是硫酸铜(CuSO4),而不是蓝矾。
溶液的导电性:
探究溶液导电性的实验:
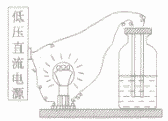
用如图所示的装置试验一些物质的导电性。可以养到蒸馏水、乙醉不导电,而盆酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、碳酸钠溶液均能导电。
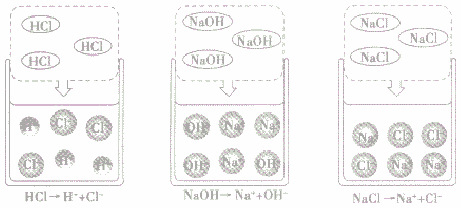
酸、碱、盐溶液导电的原因:
酸、碱、盐溶于水,在水分子作用下,电离成自由移动的带正(或负)电的阳(或阴)离子(如下图所示)。因此酸、碱、盐的水溶液都能导电,导电的原因是溶液中存在自由移动的离子,而蒸馏水和乙醇中不存在自由移动的离子。
发现相似题
与“某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含...”考查相似的试题有:
- 配制一定质量分数的NaCl溶液,不需要用到的仪器是( )A.托盘天平B.烧杯C.酒精灯D.玻璃棒
- 下列说法中,正确的是[ ]A、溶液都具有均一、稳定、无色、透明等性质B、10g食盐溶液的溶质质量分数一定比5g食盐溶液的溶质质...
- 以下的变化曲线分别与相应的操作过程相对应,其中正确的是( )A.20℃时,向一杯水中加入KNO3晶体B.将一瓶浓硫酸敞口放置在...
- 学好化学可以使你从感性走向理性,助你学以致用.已知溶液是一种均一、稳定的混合物.根据均一性可以总结出“溶液中各处的颜色...
- 某温度时,将烧杯中的xgKNO3饱和溶液恒温下蒸发部分溶剂,再将烧杯中的物质逐渐升温(假设升温时溶剂没有损失),能够正确表...
- 下列关于溶液的叙述,正确的是[ ]A.不饱和溶液一定是稀溶液B.同一溶质的饱和溶液一定比不饱和溶液浓C.氯化钠的饱和溶液中...
- 我国具有悠久的酿酒历史.某白酒的标签上注有“53°”字样,它表示( )A.该酒在53℃的条件下酿制的B.该酒的着火点是53℃C.100g...
- 从1升10%的溶液中取出100毫升,那么剩下900毫升溶液的质量分数为[ ]A.1%B.9%C.11.1%D.10%
- 下列物质属于溶液的是[ ]A.食盐水B.油水C.泥水D.蒸馏水
- 下列关于溶液的叙述中,正确的是[ ]A.溶液都是无色的B.溶液都是纯净物C.溶液都是混合物D.溶液中都有水