本试题 “高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又是絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式为:Fe(OH)3+ ClO-+OH-→FeO42-+Cl-+H2O(未配平) 下列有...” 主要考查您对氧化剂、还原剂
氧化性、还原性强弱的比较
元素化合价的求法
水的净化与处理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 氧化性、还原性强弱的比较
- 元素化合价的求法
- 水的净化与处理
氧化剂:
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 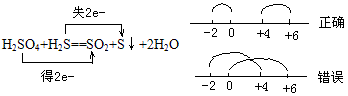
求化合价的原则:
在化合物中,正负化合价的代数和为0。
化合价规律:
1.在单质中,元素的化合价为0。
2.在化合物中,氢常显+1价,氧显-2价。金属元素通常显正价,非金属元素显负价。在非金属氧化物中,氧显-2价,非金属元素显正价,因而非金属元素可以有正价和负价。
3.在不同的条件下,某元素可以表现出不同的化合价
4.原子团也表现化合价,其化合价数值由构成原子的正负化合价的代数和算出。
常见元素化合价口诀:
一价氢氯钾钠银,
二价氧钙钡镁锌,
三铝、四硅、五价磷,
二三铁、二四碳,二四六硫都齐全,
氢一氧二为标准,
铜汞二价最常见,
单质价数都为零。
负一氢氧硝酸根
负二硫酸碳酸根负
三记住磷酸根
正一价的是铵根
水的净化:
(1)基本流程:天然水+混凝剂过滤→清洁水+消毒剂→饮用水天然水中溶解的主要气体是O2、CO2、H2S。
(2)除去水中的固体杂质和悬浮物:常用混凝剂为铝盐(如硫酸铝、明矾、碱式氯化铝等)、三价铁盐等。原理为:Al3++3H2O=Al(OH)3(胶体)+3H+,Fe3++3H2O=Fe(OH)3(胶体)+3H+,生成的胶体能吸附水中的悬浮杂质而沉降,达到净水的效果。
(3)消毒:常用的消毒剂为氯气、漂白粉精、臭氧、二氧化氯等。对自来水进行暴晒是为了除去水中少量的次氯酸。水处理剂能杀菌消毒是因为它具有强氧化性。过氧化钠不能用于自来水的杀菌消毒。O3消毒的反应产物无毒无害。
(4)消除水中的异味:活性炭颗粒的比表面积大,吸附能力强,让水通过由细小的活性炭颗粒组成的滤床能够除去水中的异味。活性炭在水的净化过程中只发生物理变化。通入CO2可以除去水中的Ca离子和调节溶液的pH
污水处理:
(1)生物化学方法通常使用含有大量需氧微生物的活性污泥,在强力通入空气的条件下,微生物以水中的有机废物为养料生长繁殖,将有机物分解为二氧化碳、水等无机物,从而达到净化污水的目的。
(2)中和法酸性废水常用熟石灰中和,碱性废水常用H2SO4或CO2中和。
(3)③沉淀法 Hg2+、Pb2+、Cu2+等重金属离子可用Na2S除去,反应的离子方程式为Hg2++S2-===HgS↓,Pb2++S2-===PbS↓,Cu2++S2-===CuS↓。
注意:
①一般不采用离子交换法,因为离子交换法价格昂贵。
②过滤用到的玻璃仪器出烧杯外,还有漏斗、玻璃棒
③分离Hg是需在通风橱中进行,原因是Hg有挥发性,且有毒
④回收纯净的金属铜时应增加冷凝回流装置以防止污染。
3.水质检测的项目:BOD、有机物、N、P、重金属、pH值、悬浮物、溶解性固体、总碱度
富营养化的检测项目:水样的总铅、总铜、总铁、阴离子表面活性剂、氨氮值
(1)基本流程:天然水+混凝剂过滤→清洁水+消毒剂→饮用水天然水中溶解的主要气体是O2、CO2、H2S。
(2)除去水中的固体杂质和悬浮物:常用混凝剂为铝盐(如硫酸铝、明矾、碱式氯化铝等)、三价铁盐等。原理为:Al3++3H2O=Al(OH)3(胶体)+3H+,Fe3++3H2O=Fe(OH)3(胶体)+3H+,生成的胶体能吸附水中的悬浮杂质而沉降,达到净水的效果。
(3)消毒:常用的消毒剂为氯气、漂白粉精、臭氧、二氧化氯等。对自来水进行暴晒是为了除去水中少量的次氯酸。水处理剂能杀菌消毒是因为它具有强氧化性。过氧化钠不能用于自来水的杀菌消毒。O3消毒的反应产物无毒无害。
(4)消除水中的异味:活性炭颗粒的比表面积大,吸附能力强,让水通过由细小的活性炭颗粒组成的滤床能够除去水中的异味。活性炭在水的净化过程中只发生物理变化。通入CO2可以除去水中的Ca离子和调节溶液的pH
污水处理:
(1)生物化学方法通常使用含有大量需氧微生物的活性污泥,在强力通入空气的条件下,微生物以水中的有机废物为养料生长繁殖,将有机物分解为二氧化碳、水等无机物,从而达到净化污水的目的。
(2)中和法酸性废水常用熟石灰中和,碱性废水常用H2SO4或CO2中和。
(3)③沉淀法 Hg2+、Pb2+、Cu2+等重金属离子可用Na2S除去,反应的离子方程式为Hg2++S2-===HgS↓,Pb2++S2-===PbS↓,Cu2++S2-===CuS↓。
注意:
①一般不采用离子交换法,因为离子交换法价格昂贵。
②过滤用到的玻璃仪器出烧杯外,还有漏斗、玻璃棒
③分离Hg是需在通风橱中进行,原因是Hg有挥发性,且有毒
④回收纯净的金属铜时应增加冷凝回流装置以防止污染。
3.水质检测的项目:BOD、有机物、N、P、重金属、pH值、悬浮物、溶解性固体、总碱度
富营养化的检测项目:水样的总铅、总铜、总铁、阴离子表面活性剂、氨氮值
发现相似题
与“高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又是絮凝净水的水处...”考查相似的试题有:
- 现有C、CO、CO2、Na2CO3四种物质,采用下列分类标准,无法将其中两种归为一类的是( )A.是否具有还原性B.是否为氧化物C....
- 近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量杂质--碳纳米颗粒。这种碳纳米颗粒可用氧化气化...
- 将二氧化硫通入溴水中发生如下的反应:SO2+Br2+2H2O===2HBr+H2SO4,反应中转移的电子数和还原剂是[ ]A.2e-,H2SO4B.4e...
- 氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:NO3-+4H++3e-=NO+2H2O。下列四种物质...
- 根据相关化学概念和原理,下列判断正确的是( )A.若某反应的反应物总能量低于生成物总能量,则该反应为放热反应B.若A2+2D-...
- 已知2KClO3+I2=2KIO3+Cl2,下列对此反应的说法不正确的是( )A.氧化产物与还原产物的物质的量比为2:1B.若在标准状况下产...
- 将NaOH溶液和CuSO4溶液按适当比列加入某人的尿液中,加热后,如果观察到砖红色沉淀出现,则此人尿液中含有 ( )。A.食醋B.食...
- 我国近海海域海水中一些元素含量普遍超标,富营养化十分严重。经常发生“赤潮”现象。下列生活用品中能引起“赤潮”的是( )A....
- 倡导“免赠贺卡”“免用一次性木筷”的出发点是( )。A.减少个人经济支出B.节约木材,保护森林C.减少扔弃垃圾D.防止传染疾病
- “西北通道”是指从北大西洋、经加拿大北极群岛进入北冰洋、再进入太平洋的航道,是连接大西洋和太平洋的捷径。最新卫星测量结...