本试题 “从海水中可以提取溴,主要反应为:2Br-+Cl2= 2Br2+2Cl-,下列说法正确的是( )A.溴离子具有氧化性 B.氯气做还原剂C.该反应属于复分解反应D.氯气的氧化性比...” 主要考查您对氧化剂、还原剂
氧化性、还原性强弱的比较
复分解反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 氧化性、还原性强弱的比较
- 复分解反应
氧化剂:
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 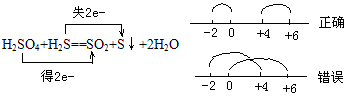
复分解反应的定义:
复分解反应是由两种化合物,通过互相交换成分并生成两种新化合物的反应,模式为AB+CD→AD+CB。它是基本类型的化学反应之一。复分解都不是氧化还原反应。
复分解反应发生的条件:
1.生成难溶的物质:如生成BaSO4、AgCl、CaCO3等沉淀。
2.生成气体或易挥发物质:如生成CO2、H2S等气体。
3.有弱电解质生成:如生成H2O、弱酸、弱碱等。
复分解反应的分类:
- 酸与盐 例如:2HCl+CaCO3=CaCl2+H2O+CO2↑
- 酸与碱 例如:H2SO4+Ba(OH)2=BaSO4↓+2H2O
- 盐与盐(可溶) 例如:Na2CO3+CaCl2=2NaCl+CaCO3↓
- 盐与碱 例如:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
- 酸与金属氧化物 例如:盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O
复分解反应的模型:
AB+CD→AD+CB
复分解反应与氧化还原反应的关系:
复分解都不是氧化还原反应。
发现相似题
与“从海水中可以提取溴,主要反应为:2Br-+Cl2= 2Br2+2Cl-,下列...”考查相似的试题有:
- 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法...
- 某一反应体系中有反应物和生成物共6种:HCl、H2SO4、SnCl2、SnCl4、FeSO4、Fe2(SO4)3,在反应后的溶液中滴加 KSCN溶液不显红...
- 将SO2通入略显酸性的Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀...
- 被称为万能还原剂的NaBH4,溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑下列说法正确的是[ ]A.NaBH4既是氧化剂又是还原剂B.Na...
- 对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是[ ]A.只有硫酸铜作氧化剂B.SO42-既不是氧化产物又不是...
- 吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人...
- 我们生活中的许多现象及大量物质的应用都与氧化还原反应有关,请运用氧化还原反应的知识回答下列问题。(1)氯气跟水反应生成的...
- 钠和铝是两种重要的金属.请回答:(1)钠元素的还原性比铝的______(填“强”或“弱”);常温下,可用______(填元素符号)制成...
- 为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:I打开弹簧夹,...
- 关于Cl2、Br2、I2、H2O2、Fe3+、SO2六种物质的氧化性相对强弱,你可以明确得出的结论有哪些?______ 推测下列过程的结果,按...