本试题 “利用学过的化学知识,可以解释实际问题。(1)“墙内开花墙外香”说明分子具有______________的性质。(2)氧气可用于潜水、登山是因为氧气_____________。(3...” 主要考查您对水污染与防治
氧气的用途
化学反应方程式的书写
分子的特点
二氧化碳的检验和验满
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水污染与防治
- 氧气的用途
- 化学反应方程式的书写
- 分子的特点
- 二氧化碳的检验和验满
水体污染的定义:
大量的污染物质排入水体,超过水体的自净能力使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁的情况。
水体污染来源:
a.工业污染:座水、废渣、废气《工业“三反”》。
b.农业污染:化肥、农药的不合理使川。
c.生活污染:含磷洗涤剂的大量使用、生活污水的任意排放等。
防治措施:
a.工业上:通过应用新技术、新工艺减少污染物的产生,同时对污染的水体作处理使之符合排放标准。
b.农业上:提们使川农家肥,合理使用化肥和农药。
c.生活污水也应逐步实现欲中处理和排放。
水体的自净能力:
广义的水体自净是指在物理、化学和生物作用下.受污染的水体逐渐自然净化,水质复原的过程。,狭义的水体自净是指水体叶I微生物氧化分解有机污染物而使水体净化的过程。水体自净大致分为三类,即物理净化、化学净化和生物净化。它们同时发生,相互影响,共同作用。
(1)物理净化。物理净化是指污染物质由于稀释、扩散、混合和沉淀等过程而浓度降低。污水进入水体后,大颗粒的不溶性固体在水流较弱的地方逐渐沉入水底,形成污泥。悬浮体、胶体和可溶性污染物因混合、稀释,浓度逐渐降低。
(2)化学净化。化学净化是指污染物由于氧化还原、酸碱反应、分解、化合和吸附凝聚等化学或物理作用而浓度降低。流动的水体从水面上大气中溶人氧气,使污染物中铁、锰等重金属离子氧化,生成难溶性物质析出沉降。某些元素在一定酸性环境中,形成易溶性化合物,随水漂移而稀释;在中性或碱性条件下,某些元素形成难溶化合物而沉降。天然水中的胶体,吸附和凝聚水中悬浮物质微粒,随水流移动或逐渐沉降。
(3)生物净化,又称生物化学净化。是指生物活动尤其是微生物对有机物的氧化分解使污染物质的浓度降低。
城市污水及处理:
(1)城市污水城市污水包括生活污水、工业废水和径流污水等,由城市排水管网汇集并输送到污水处理厂进行处理。城市污水的污染,一般经历三个历史时期:病源污染期、总体污染期和新污染期。在病源污染期,城市污水主要是生活污水。由于污水中含有病菌和病毒,污水排入水体后往往会传染疾病。在总体污染期,随着工业的发展和人口的集中,城市污水量及所含的污染物种类不断增加。污水排入水体后,造成水体中悬浮物数量和生化需氧量越来越大,水体缺氧,水生生物灭绝。在新污染期,由于工业的高度发展,污水所含的污染物种类更加复杂。工业废水日益成为城市污水处理中的主要对象。
(2)城市污水处理城市污水处理分为三个级别.分别称为污水一级处理、污水二级处理、污水三级处理。一级处理应用物理处理方法,即用格栅、沉砂池、初沉池、活性污泥池、二次沉淀池等构筑物,去除污水中不溶解的污染物和寄生虫卵。二级处理应用生物处理方法,即主要通过微生物的代谢作用进行物质转化的过程,将污水巾各种复杂的有机物降解为简单的物质。生物处理对污水水质、水温、供氧量等都有一定的要求。三级处理是用生物化学(硝化一反硝化)法、碱化吹脱法或离子交换法除氮,用化学沉淀法除磷,用臭氧氧化法、活性炭法或超过滤法除去难降解有机物,用反渗透法除去盐类,用氯化法消毒等过程中的一种或几种组成的污水处理工艺。
大量的污染物质排入水体,超过水体的自净能力使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁的情况。
水体污染来源:
a.工业污染:座水、废渣、废气《工业“三反”》。
b.农业污染:化肥、农药的不合理使川。
c.生活污染:含磷洗涤剂的大量使用、生活污水的任意排放等。
防治措施:
a.工业上:通过应用新技术、新工艺减少污染物的产生,同时对污染的水体作处理使之符合排放标准。
b.农业上:提们使川农家肥,合理使用化肥和农药。
c.生活污水也应逐步实现欲中处理和排放。
水体的自净能力:
广义的水体自净是指在物理、化学和生物作用下.受污染的水体逐渐自然净化,水质复原的过程。,狭义的水体自净是指水体叶I微生物氧化分解有机污染物而使水体净化的过程。水体自净大致分为三类,即物理净化、化学净化和生物净化。它们同时发生,相互影响,共同作用。
(1)物理净化。物理净化是指污染物质由于稀释、扩散、混合和沉淀等过程而浓度降低。污水进入水体后,大颗粒的不溶性固体在水流较弱的地方逐渐沉入水底,形成污泥。悬浮体、胶体和可溶性污染物因混合、稀释,浓度逐渐降低。
(2)化学净化。化学净化是指污染物由于氧化还原、酸碱反应、分解、化合和吸附凝聚等化学或物理作用而浓度降低。流动的水体从水面上大气中溶人氧气,使污染物中铁、锰等重金属离子氧化,生成难溶性物质析出沉降。某些元素在一定酸性环境中,形成易溶性化合物,随水漂移而稀释;在中性或碱性条件下,某些元素形成难溶化合物而沉降。天然水中的胶体,吸附和凝聚水中悬浮物质微粒,随水流移动或逐渐沉降。
(3)生物净化,又称生物化学净化。是指生物活动尤其是微生物对有机物的氧化分解使污染物质的浓度降低。
城市污水及处理:
(1)城市污水城市污水包括生活污水、工业废水和径流污水等,由城市排水管网汇集并输送到污水处理厂进行处理。城市污水的污染,一般经历三个历史时期:病源污染期、总体污染期和新污染期。在病源污染期,城市污水主要是生活污水。由于污水中含有病菌和病毒,污水排入水体后往往会传染疾病。在总体污染期,随着工业的发展和人口的集中,城市污水量及所含的污染物种类不断增加。污水排入水体后,造成水体中悬浮物数量和生化需氧量越来越大,水体缺氧,水生生物灭绝。在新污染期,由于工业的高度发展,污水所含的污染物种类更加复杂。工业废水日益成为城市污水处理中的主要对象。
(2)城市污水处理城市污水处理分为三个级别.分别称为污水一级处理、污水二级处理、污水三级处理。一级处理应用物理处理方法,即用格栅、沉砂池、初沉池、活性污泥池、二次沉淀池等构筑物,去除污水中不溶解的污染物和寄生虫卵。二级处理应用生物处理方法,即主要通过微生物的代谢作用进行物质转化的过程,将污水巾各种复杂的有机物降解为简单的物质。生物处理对污水水质、水温、供氧量等都有一定的要求。三级处理是用生物化学(硝化一反硝化)法、碱化吹脱法或离子交换法除氮,用化学沉淀法除磷,用臭氧氧化法、活性炭法或超过滤法除去难降解有机物,用反渗透法除去盐类,用氯化法消毒等过程中的一种或几种组成的污水处理工艺。
用途作用:
1. 冶炼工艺 在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,这不但降低了钢的含碳量,还有利于清除磷、硫、硅等杂质。而且氧化过程中产生的热量足以维持炼钢过程所需的温度,因此,吹氧不但缩短了冶炼时间,同时提高了钢的质量。高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。在有色金属冶炼中,采用富氧也可以缩短冶炼时间提高产量。
2. 化学工业
在生产合成氨时,氧气主要用于原料气的氧化,以强化工艺过程,提高化肥产量。再例如,重油的高温裂化,以及煤粉的气化等。
3. 国防工业
液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧炸药。
4. 医疗保健
供给呼吸:用于缺氧、低氧或无氧环境,例如:潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
5. 其它方面
如:它本身作为助燃剂与乙炔、丙烷等可燃气体配合使用,达到焊割金属的作用,各行各业中,特别是机械企业里用途很广,作为切割之用也很方便,是首选的一种切割方法。
过度吸氧负作用:
早在19世纪中叶,英国科学家保尔·伯特首先发现,如果让动物呼吸纯氧会引起中毒,人类也同样。氧气瓶氧气瓶人如果在大于0.05MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各脏器缺氧而发生损害。在0.1MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。人在0.2MPa(2个大气压)高压纯氧环境中,最多可停留1.5小时~2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。如加入0.3MPa(3个大气压)甚至更高的氧,人会在数分钟内发生脑细胞变性坏死,抽搐昏迷,导致死亡。
此外,过量吸氧还会促进生命衰老。进入人体的氧与细胞中的氧化酶发生反应,可生成过氧化氢,进而变成脂褐素。这种脂褐素是加速细胞衰老的有害物质,它堆积在心肌,使心肌细胞老化,心功能减退;堆积在血管壁上,造成血管老化和硬化;堆积在肝脏,削弱肝功能;堆积在大脑,引起智力下降,记忆力衰退,人变得痴呆;堆积在皮肤上,形成老年斑。
缺氧和富氧对人体的影响:
氧气浓度(%体积)---征兆(大气压力下)
100%---致命/6分钟;
50%---致命/4-5分钟经治疗可痊愈
>23.5%---富氧,有强烈爆炸危险
20.9%---氧气浓度正常
19.5%---氧气最小允许浓度
15-19%---降低工作效率,并可导致头部、肺部和循环系统问题
10-12%---呼吸急促,判断力丧失,嘴唇发紫
8-10%---智力丧失,昏厥,无意识,脸色苍白,嘴唇发紫,恶心呕吐
6-8%---8分钟;
4-6%---40秒内抽搐,呼吸停止,死亡
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
分子的基本性质:
(1)分子的体积和质量都很小,如1个水分子的质量约为3×1026kg,1滴水中大约有1.67×1021个水分子。
(2)分子在不断运动着。能闻到远处的花香,品红在水中的扩散都是分子运动的结果。分子的运动速率随温度升高而加快。
(3)分子间具有一定的间隔。最好的证明就是:取50毫升酒精和50毫升水,混合之后,体积却小于100毫升。物质的热胀冷缩就是因为物质分子间的间隔受热增大,遇冷缩小。
(4)不同种物质的分子性质不同。
(5)在化学反应中分子可以再分。
二氧化碳的检验和验满:
1.检验:用燃着的木条检验,如果木条熄灭,则证明有二氧化碳存在;
或用澄清石灰水检验,如果澄清石灰水变浑浊,则证明有二氧化碳存在

2.验满:将燃着的木条放在瓶口,若熄灭则证明二氧化碳已满
常见气体的检验:
1.检验:用燃着的木条检验,如果木条熄灭,则证明有二氧化碳存在;
或用澄清石灰水检验,如果澄清石灰水变浑浊,则证明有二氧化碳存在

2.验满:将燃着的木条放在瓶口,若熄灭则证明二氧化碳已满
常见气体的检验:
| 物质 | 检验试剂或方法或装置或步骤 | 反应现象 | 结论和化学式 |
| O2 | 带火星的木条 | 木条复燃 | 氧气能支持燃烧 |
| CO2 | 澄清石灰水 | 澄清石灰水变浑浊 | CO2+Ca(OH )2==CaCO3↓+H2O |
| CO | 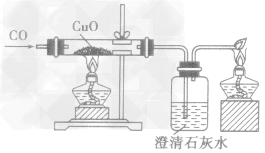 |
氧化铜由黑色变成红色,澄清石灰水变浑浊 | CO+CuO Cu+CO2 Cu+CO2Ca(OH)2+CO2==CaCO3↓+H2O |
| H2 |  |
氧化铜由黑色变成红色,无水CuSO4变成蓝色 | H2+CuO H2O+Cu H2O+CuCuSO4+5H2O==CuSO4·5H2O |
| H2O(g) |  |
无水CuSO4变蓝 | CuSO4+5H2O==CuSO4·5H2O |
| CH4 | (1)点燃 (2)火焰上方罩一个干燥的烧杯 (3)罩一个内壁用澄清石灰水润洗过的烧杯 |
(1)产生蓝色火焰 (2)烧杯内壁有水珠生成 (3)澄清石灰水变浑浊 |
CH4+O2 CO2+H2O CO2+H2OCa(OH)2+CO2==CaCO3↓+H2O |
| NH3 | (1)闻气味 (2)利用湿润的红色石蕊试纸检验 |
(1)有氨臭味 (2)湿润的红色石蕊试纸变蓝 |
—— |
发现相似题
与“利用学过的化学知识,可以解释实际问题。(1)“墙内开花墙外...”考查相似的试题有:
- 2011年3月11日,日本发生9.0级大地震,造成数百万人饮水困难。水是生命之源。认识水资源、合理利用和保护水资源是我们义不容...
- (10分)完成下列变化的化学方程式,并按要求填空。(1)镁条在空气中燃烧 _____________________________,点燃镁条时使用的...
- 实验室开放日,同学们来到实验室,利用下列装置进行气体的制取和气体性质的探究.(1)图中标有①、②的仪器名称:①______;②__...
- 按要求写出下列化学方程式:(1)硫粉在空气中燃烧______,(2)加热黑白混合固体制氧气______,(3)氢氧化钠在空气中变质__...
- 2013年6月,我国拟用长征二号改进型火箭发射神舟十号载人飞船,火箭所用的燃料液态偏二甲肼(C2H8N2)与N2O4发生的反应可写作...
- 某元素原子结构示意图为。(1)该元素原子核内有___个质子,原子最外电子层上有______个电子。(2)用符号表示:镁离子____。(3)...
- 在通常情况下,铜不与稀硫酸反应。但在供给充足空气(氧气),并在加热的条件下,铜在稀硫酸中能缓慢的减少,生成硫酸铜和水。(...
- 回答有关问题:(1)河流附近居民时常能闻到垃圾散发出的臭味,这是因为分子______.(2)在社会主义新农村建设中,人们常用...
- 有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱.通过实验有以下现象:A溶液与B溶液混合无明显现象;A溶液与...
- 物质由______构成的,微粒是在______,微粒之间存在______.