本试题 “铜、氧气、二氧化碳、过氧化氢和一氧化碳是初中化学中常见的物质,下图是它们的部分应用.这些物质中:(1)铜常用于制作导线,因为其有良好的延展性和______...” 主要考查您对氧气的制取和收集
化学反应方程式的书写
文字表达式
金属的化学性质
金属的冶炼(铁的冶炼)
二氧化碳的用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧气的制取和收集
- 化学反应方程式的书写
- 文字表达式
- 金属的化学性质
- 金属的冶炼(铁的冶炼)
- 二氧化碳的用途
氧气的制取是初中化学的重点,也是历年中考的热点。我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。中考对制取氧气的考查主要集中在药品选用、实验装置、操作步骤等方面。
实验室制取收集氧气:
| 过氧化氢制氧气 | 高锰酸钾制氧气 | |
| 药品和反应原理 | 2H2O2 2H2O+O2↑ 2H2O+O2↑ |
2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| 发生装置 | 固液常温型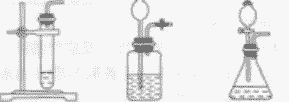 |
固体加热型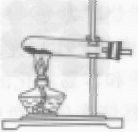 |
| 收集装置 | 氧气可用排水法收集,也可用向上排空气法收集 | |
| 整体装置图 | 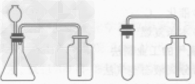 |
 |
| 操作步骤 | ①检查装置气密性 ②再锥形瓶中装入二氧化锰 ③塞好带有长颈漏斗和导管的橡皮塞(长颈漏斗的下端一定在液面以下,否则氧气会从长颈漏斗中跑出来) ④向长颈漏斗中加入过氧化氢溶液 ⑤收集氧气 |
①检查装置气密性 ②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花) ③将试管固定在铁架台上 ④点燃酒精灯,预热后加热试管 ⑤当导管口有连续均匀的气泡冒出时开始收集气体 ⑥收集完毕,先将导管移出水面 ⑦熄灭酒精灯。加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。可用谐音记忆为“茶庄定点收利息”。 |
| 注意事项 | ①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。 ②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。 ③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。 ④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。 |
①药品要平铺在试管底部,均匀受热。 ②试管口要略向下倾斜,防止药品中湿存的水分受热后变成水蒸气,遇冷凝结成水倒流回试管底部,使试管炸裂。 ③铁架台的铁夹要夹在试管的中上部(或距离试管口1/3处)。 ④试管内的导管稍伸出橡皮塞即可,这样便于气体导出。 ⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。 ⑥加热时要先使试管均匀受热,然后酒精灯外焰要对准药品所在部位加热。 ⑦用排水法收集气体时,应注意当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有大盆气泡冒出时,证明已集满。 ⑧停止加热时,应先把导管从水里撤出,再撤掉酒精灯。如果先熄灭酒精灯,试管内气体温度降低,压强减小,水槽中的水就会被倒吸入热的试管内,使试管炸裂。 ⑨用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾小颗粒进人导管。 ⑩盛氧气的集气瓶应盖上玻璃片正放,因为在相同状况下氧气的密度大于空气的密度,正放可减少气体的逸散。 |
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
概念:用文字表示化学反应的式子
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
金属的化学性质:
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
2.金属与酸的反应
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 |
点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 | 2Cu+O2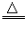 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | —— | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
金属冶炼:
金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉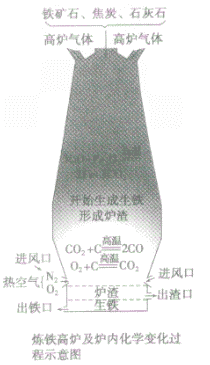
④高炉内有关反应:
a.产生CO提供能量:C+O2 CO2;CO2+C
CO2;CO2+C 2CO
2CO
b.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3 2Fe + 3CO2
2Fe + 3CO2
c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3
⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2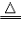 3Fe+4H2O
3Fe+4H2O
b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO 2Fe +3CO2
2Fe +3CO2
炼锌的反应万程式为2ZnO+C 2Zn+CO2↑
2Zn+CO2↑
c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4 9Fe+4Al2O3
9Fe+4Al2O3
d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融) 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2 ②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉

④高炉内有关反应:
a.产生CO提供能量:C+O2
 CO2;CO2+C
CO2;CO2+C 2CO
2COb.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3
 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2
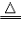 3Fe+4H2O
3Fe+4H2O b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO
 2Fe +3CO2
2Fe +3CO2炼锌的反应万程式为2ZnO+C
 2Zn+CO2↑
2Zn+CO2↑ c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4
 9Fe+4Al2O3
9Fe+4Al2O3 d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融)
 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑ e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
二氧化碳用途:
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
发现相似题
与“铜、氧气、二氧化碳、过氧化氢和一氧化碳是初中化学中常见的...”考查相似的试题有:
- 根据下列装置图,按要求回答有关问题:(1)写出图中带有标号仪器的名称:a b 。(2)实验室用大理石和稀盐酸制取并收集二氧...
- (9分)结合下图所示实验装置,回答下列问题:(1)实验室用高锰酸钾制取氧气时,应选用 装置做气体发生装置(填字母),其反...
- 实验室选用下图所示装置制取和收集气体,根据要求回答下列问题。(1)指出标号的仪器名称①________,②_________。(2)实验室...
- 工业上用电解水的方法制高纯度的氧气,该反应的化学方程式______,该反应的基本反应类型______;该反应中在阳极产生的气体是_...
- 现有如下试剂:①烧碱溶液②硫酸钠溶液③盐酸④水,请分别选择一种试剂除去下列物质中的少量杂质(括号内为杂质),(1)把选择的...
- 回答下列问题〔(1)(2)小题用化学方程式回答;(3)(了)小题用简要的文字加答〕(1)“胃复宁胶囊”是一种胃药,其主要成...
- 下列化学方程式书写正确的是( )A.铁在氧气中燃烧4Fe+3O 点燃 . 2Fe2O3B.氧化汞加热分解HgO=Hg+O2↑C.硫在氧气中燃烧S+O ...
- 利用曲线图对化学实验中的数据进行分析可以帮助我们对研究对象形成规律化的认识,下列各选项中观察曲线图后得到的结论正确的...
- 首辆会飞的汽车在荷兰问世,该车空中时速可达190公里,加满油后一次最远可飞行约550公里,价格跟豪华轿车差不多。请回答下列...
- 按要求选择适当的物质,用其前面的字母填空.A.肥皂水 B.干冰 C.洗洁精 D.食醋(1)人工降雨可使用_________.(2)除去...