本试题 “已知X、Y、Z、T四种元素中,只有T不是短周期元素,与它们有关的部分信息如下表(1)Y元素在周期表中的位置为________,写出X原子核外电子排布的轨道表示式:___...” 主要考查您对氢氧化铝
轨道表示式
元素的性质
元素周期表
元素的推断
电离方程式
金属的冶炼
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氢氧化铝
- 轨道表示式
- 元素的性质
- 元素周期表
- 元素的推断
- 电离方程式
- 金属的冶炼
氢氧化铝的性质:
不溶于水的白色胶状物质;能凝聚水中的悬浮物,可用作净水剂、可治疗胃酸过多、作糖的脱色剂等;既能与酸反应,又能与碱反应。
(1)与酸反应:Al(OH)3+3H+==Al3++3H2O
(2)与碱反应:Al(OH)3+OH-==AlO2-+2H2O
氢氧化铝的性质:
- 氢氧化铝是一种白色不溶于水的胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。
- 氢氧化铝既能与强酸反应也能与强碱反应,是两性氢氧化物。
- 氢氧化铝是医用的胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,是胃液酸度降低,起到中和过多胃酸的作用。
- 氢氧化铝受热是分解成氧化铝和水。2Al(OH)3=(加热)=Al2O3+3H2O
氢氧化铝的制备:
实验室制法:Al2(SO4)3+6NH3·H2O==(NH4)2SO4+Al(OH)3↓
其他制法:①AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
②2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
③AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
④3AlO2-+Al3++6H2O==4Al(OH)3↓
例题:用稀H2SO4、NaOH溶液和金属铝为原料制取Al(OH)3。
甲、乙、丙三个学生的制备途径分别是
甲:
乙: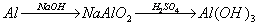
丙: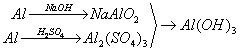
若要得到等量的Al(OH)3,则( B )
A.三者消耗的原料相同 B.甲消耗的原料的总物质的量最多 C.乙消耗的原料的总物质的量最少 D.丙消耗的原料的总物质的量最多
有关Al(OH)3的计算及图象分析:
解答有关Al(OH)3的图象和计算问题要注意以下三点:
(1)“铝三角”关系图中各物质转化方程式中的化学计量数关系。
(2)铝元素的存在形式。
(3)图象分析时:首先要看清横、纵坐标的含义,其次要对图象进行全面的分析,尤其需要关注的是特殊点(起点、折点、顶点、终点)的含义。
1、铝盐与强碱溶液作用生成Al(OH)3沉淀的计算
反应关系如下:
(1)Al3++3OH-==Al(OH)3(生成沉淀)
(2)Al(OH)3+OH-==AlO2-+2H2O(沉淀溶解)
(3)Al3++4OH-==AlO2-+2H2O(生成沉淀,又恰好溶解)
分析以上三个化学反应方程式,所得Al(OH)3沉淀的物质的量与n(Al3+)、n(OH-)的关系为:
当 ≤3时,所得沉淀的物质的量:n[Al(OH)3]=
≤3时,所得沉淀的物质的量:n[Al(OH)3]=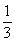 n(OH-)
n(OH-)
当 ≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
当3< <4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
<4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)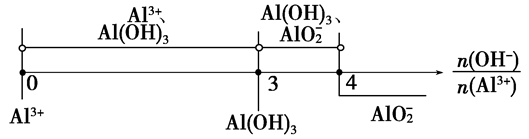
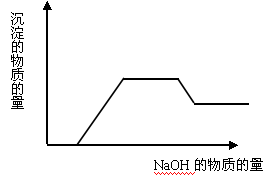
2、有关Al(OH)3的图像分析
①向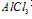 溶液中滴加
溶液中滴加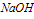 溶液
溶液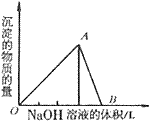
O~A段: 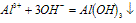
A~B段: 
②向强碱溶液中滴入铝盐溶液 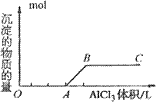
O~A段: 
A~B段: 
③向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液
A. 向铝盐中滴加氨水时,当氨水增加到 时,产生最大沉淀量
时,产生最大沉淀量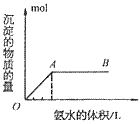
B. 向氨水中滴加铝盐溶液时,开始时氨水过量,如图所示 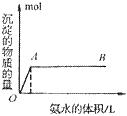
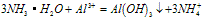
分析得:氢氧化铝不溶于弱碱氨水中。
④向偏铝酸盐溶液中滴入强酸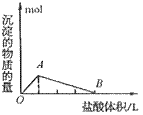
O~A段:
O~B段: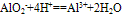
⑤向盐酸中滴加偏铝酸盐溶液 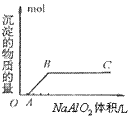
O~A段: 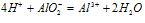
A~B段: 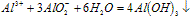
方法与技巧:
- 利用互滴顺序不同,现象不同可检验的溶液
(1)AlCl3溶液和盐酸
(2)NaAlO2溶液和盐酸
(3)Na2CO3溶液和盐酸
(4)AgNO3溶液和氨水 - 当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH4+、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,NaOH先与H+反应,再与Mg2+、Al3+反应生成沉淀,再与NH4+反应,最后才溶解Al(OH)3沉淀。一般是按生成水、沉淀、气体的顺序反应。可用图像表示为:
- AlO2-与HCO3-的反应不属于水解相互促进的反应,而是HCO3-电离出的H+与AlO2-发生的反应:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
每一个原子轨道用1个方框表示,在方框内标明基态原子核外电子分布的式子称为轨道表示式。如:
Na
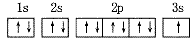
C
由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。
碱金属元素的性质:
(1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强
(2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
(3)化合物性质
同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。
注: ①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。 ②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2
 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。 (2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
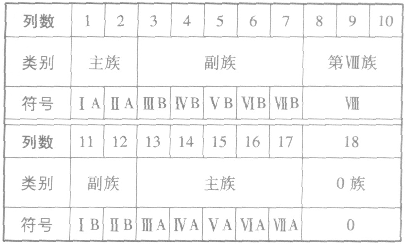
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
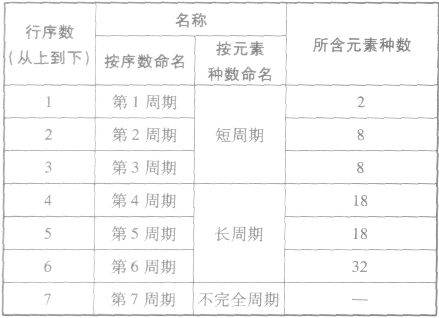
(2)族
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
元素性质推断知识点归纳:
(1)质量最轻的元素是氢(H),其单质可以填充气球;质量最轻的金属是锂(Li);熔点最高的非金属单质是石墨;熔点最高的金属单质是钨(W);熔点最低的金属单质是汞(Hg)。
(2)地壳中含量最多是氧(O),其次是Si、Al、Fe、Ca、Na、K、Mg、H、Ti。
(3)既难得电子,又难失电子且为单原子分子的气体是稀有气体。
(4)最高正价与最低负价绝对值之差为4的是硫(S);最高正价与最低负价绝对值之差为零的是碳(C)和硅(Si)。
(5)碳(C)是形成化合物最多的元素,是构成有机物的骨架元素,可形成多种同素异形体,其中硬度最大的是金刚石,而C60是分子晶体,熔点较低。
(6)常温下能与水反应放出氧气,单质是氟(F2),化合物是过氧化钠(Na2O2)。
(7)硅(Si)是构成地壳岩石骨架的主要元素,单质硅可被强碱溶液腐蚀且能放出氢气,还能被弱酸氢氟酸所溶解。
(8)能在空气中自然的非金属单质是白磷(P4),白磷有毒,能溶于CS2,和红磷互为同素异形体,红磷不能自然,不溶于CS2,白磷与红磷在一定的条件下可以相互转化。
(9)既能在二氧化碳中燃烧,又能在氮气中燃烧的金属是Mg,既能与酸溶液又能与碱溶液作用且均放出氢气的金属是铝(Al)。
(10)同一元素的气态氢化物和最高价氧化物的水化物化合生成盐的元素一定是氮(N)。
(11)同一元素的气态氢化物和气态氧化物反应生成该元素得单质和水,该元素可能是氮(N)或硫(S)。
(12)光照时可以释放电子的是铷(Rb)和铯(Cs);常温下呈液态的金属是汞(Hg),非金属单质是溴(Br2)。
解元素推断题必备知识归纳
(1)与元素的原子结构相关知识归纳
①最外层电子数等于次外层电子数的元素是Be、Ar;最外层电子数是次外层电子数2倍的元素有C;最外层电子数是次外层电子数3倍的元素有O;最外层电子数是次外层电子数4倍的元素有Ne。
②次外层电子数是最外层电子数2倍的元素有Li、Si;次外层电子数是最外层电子数4倍的元素有Mg。
③内层电子数是最外层电子数2倍的元素有Li、P;电子总数是最外层电子数2倍的元素有Be。原子核内无中子的元素是11H。
④常见等电子微粒:
|
电子数 |
分子 |
阳离子 |
阴离子 |
|
2 |
H2、He |
Li+、Be2+ |
H- |
|
10 |
Ne、HF、H2O、NH3、CH4 |
Na+、Mg2+、Al3+、H3O+、NH4+ | O2-、F-、OH-、NH2- |
|
18 |
Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4、C2H6、CH3OH |
K+、Ca2+ |
S2-、HS-、Cl- |
①主族序数与周期序数相同的元素有H、Be、Al;主族序数是周期序数2倍的元素有C、S;主族序数是周期序数3倍的元素有O。
②周期序数是主族序数2倍的元素有Li、Ca;周期序数是主族序数3倍的元素有Na。
③最高正价与最低负价的绝对值相等的元素有C、Si;最高正价是最低负价的绝对值3倍的元素有S。
④上一周期元素所形成的阴离子和下一周期元素最高价态阳离子的电子层结构与上一周期零族元素原子的电子层结构相同。
(3)与元素性质相关知识归纳
①元素所形成的单质及化合物的物理特性
A.颜色:常温下,单质为有色气体的元素是F、Cl;单质为淡黄色固体的元素是S;焰色反应火焰呈黄色的元素是Na,呈紫色的元素是K(通过兰色钴玻璃)。
B.状态:常温下,单质呈液态的非金属元素是Br;单质为白色蜡状固体的元素是P。
C.气味:有臭鸡蛋气味的非金属元素是S。
D.熔点:单质熔点最低的金属元素是Hg;熔点最高的金属元素是W。单质熔点最高的非金属元素是C。氢化物熔点最高的非金属元素是O。氧化物熔点最高的非金属元素是Si。
E.硬度:单质为天然物质中硬度最大的元素是C。
F.密度:单质最轻的金属元素是Li;单质最轻的非金属元素是H。
G.溶解性:气态氢化物最易溶于水的元素是N。
H.导电性:单质能导电的非金属元素是C;单质属于半导体材料的是Si。
②元素所形成的单质及化合物的化学特性
A.无正价、无含氧酸的元素是F;单质氧化性最强、其氢化物水溶液可雕刻玻璃的元素是F;气态氢化物稳定性最强的元素是F;最高价氧化物对应的水化物酸性最强的元素是Cl。
B.其两种同素异形体对人类生存都非常重要的元素是O(O3层被称为人类和生物的保护伞);气态氢化物与最低价氧化物能反应生成单质的是S。
C.气态氢化物与最高价氧化物对应水化物能起化合反应的元素是N;气态氢化物能使湿润的红色石蕊试纸变蓝的元素是N;其中一种同素异形体在空气中能自燃的元素是P。
③元素性质递变规律
A.元素金属性强弱比较规律
I.依据元素周期表,同一周期中,从左到右,金属性逐渐减弱;同一主族中,由上到下,金属性逐渐增强。
II.依据最高价氧化物的水化物碱性强弱,碱性越强,金属性越强。
III.依据金属活动性顺序(极少数例外)。
IV.依据金属单质与酸或水反应的剧烈程度,反应越剧烈,金属性越强。
V.依据金属单质与盐溶液之间的置换反应。
VI.依据原电池原理,原电池中作负极的金属比作正极的金属金属性强。
VII.依据电解原理,电解时,阴极上后析出的金属比先析出的金属金属性强。
B.元素非金属性强弱比较规律
I.依据元素周期表,同一周期中,从左到右,非金属性逐渐增强;同一主族中,由上到下,非金属性逐渐减弱。
II.依据最高价氧化物的水化物的酸性强弱,酸性越强,非金属性越强。
III.依据与H2化合的难易,越容易化合,非金属性越强。
IV.依据其气态氢化物的稳定性,稳定性越强,非金属性越强。
V.依据非金属单质与盐溶液之间的置换反应。
C.微粒半径大小比较规律
I.同周期阳离子半径随原子序数递增逐渐减小,如第3周期中:Na+>Mg2+>Al3+;同周期阴离子半径随原子序数递增逐渐减小,如第3周期中:P3->S2->Cl-。
II.同主族阳离子半径随原子序数递增逐渐增大,如第IA族中:Li<Na+<K+,同主族阴离子半径随原子序数递增逐渐增大,如第VIIA族中:F-<Cl-<Br-。
III.阳离子半径总比相应原子半径小,如Na+<Na,阴离子半径总比相应原子半径大,如S2->S。
IV.电子层结构相同的离子半径随原子序数的增大而减小,如S2->Cl->K+>Ca2+,O2->F->Na+>Mg2+>Al3+。
④元素的含量地壳中质量分数最大的元素是O,其次是Si;地壳中质量分数最大的金属元素是Al,其次是Fe;氢化物中氢元素质量分数最大的是C;所形成的有机化合物中种类最多的是C。
(3)解元素推断题的方法解答元素推断题,必须抓住原子结构和元素的有关性质,掌握元素周期表中主要规律,熟悉某些元素(短周期或前20号元素)的性质、存在和用途的特殊性,用分析推理法确定未知元素在周期表中的位置。对于有突破口的元素推断题,可利用题目暗示的突破口,联系其它条件,顺藤摸瓜,各个击破,推出结论。对无明显突破口的元素推断题,可利用题示条件的限定,逐渐缩小推求范围,并充分考虑各元素的相互关系予以推断。有时限制条件不足,则可进行讨论,得出合理结论,有时答案不止一组,只要能解释通都可以,若题目只要求一组,则选择自己最熟悉、最有把握的。有时需要运用直觉,大胆尝试、假设,再根据题给条件进行验证,也可推出。
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“
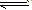 ” 。
” 。.
电离方程式的书写:
1.强电解质的电离用“ ”,弱电解质的电离用 “
”,弱电解质的电离用 “ ”。
”。
2.多元弱酸分步电离,分步持写电离方程式,一般只写第一步;多元弱碱也是分步电离的,但可按一步完全电离写出。例如:
氧硫酸: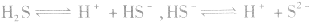
氢氧化铁:
3.强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根不完全电离。例如: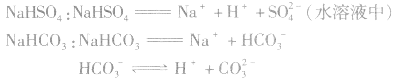
说明:在熔融状态时,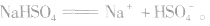
4.某些复盐能完全电离。例如:
(1)把金属从化合态变为游离态。常用冶炼法:用碳一氧化碳氢气等还原剂与金属氧化物在高温下反应。
(2)冶炼的原理
①还原法:金属氧化物(与还原剂共热)--→游离态金属
②置换法:金属盐溶液(加入活泼金属)--→游离态金属
③火法冶炼(Pyrometallurgy)又称为干式冶金,把矿石和必要的添加物一起在炉中加热至高温,熔化为液体,生成所需的化学反应,从而分离出粗金属,然后再将粗金属精炼。
④湿式冶金(Hydrometallurgy) 湿法冶金这种冶金过程是用酸、碱、盐类的水溶液,以化学方法从矿石中提取所需金属组分,然后用水溶液电解等各种方法制取金属。此法主要应用在低本位、难熔化或微粉状的矿石。现在世界上有75%的锌和镉是采用焙烧-浸取-水溶液电解法制成的。这种方法已大部分代替了过去的火法炼锌。其他难于分离的金属如镍-钴,锆-铪,钽-铌及稀土金属都采用湿法冶金的技术如溶剂萃取或离子交换等新方法进行分离,取得显著的效果。
(3)常见金属冶炼:
①汞:热分解法:2HgO
 2Hg+O2(气体)
2Hg+O2(气体) ②铜:置换法:CuSO4+Fe==Cu+FeSO4(又叫湿法炼铜)
③铝:电解法:2Al2O3
 4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)
4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)④镁:电解法:MgCl2(l)
 Mg(s)+Cl2(g)↑
Mg(s)+Cl2(g)↑ ⑤钠:电解法:2NaCl
 2Na+Cl2↑
2Na+Cl2↑ ⑥钾:原理是高沸点金属制低沸点金属:Na+KCl==K+NaCl(反应条件是高温,真空。)
⑦铁:热还原法:2Fe2O3+3C
 2Fe+3CO2↑
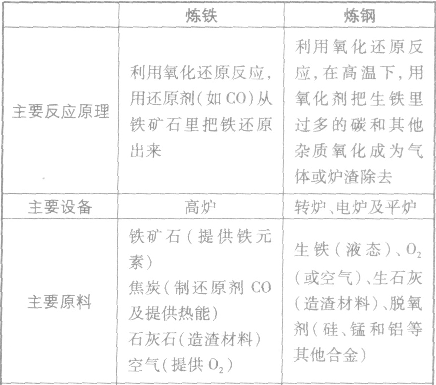
2Fe+3CO2↑ 炼铁和炼钢的比较:

铝的冶炼:
(1)由铝土矿制氧化铝
①将铝土矿中的氧化铝水合物溶解在氢氧化钠溶液中: 
②向偏铝酸钠溶液中通入二氧化碳,析出氢氧化铝: 
③使氢氧化铝脱水生成氧化铝:
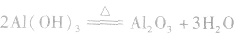
(2)电解氧化铝制备铝
电解时,以氧化铝、冰晶石(Na2AlF6)熔融液为电解质,其中也常加入少量的氟化钙等帮助降低熔点;阳极和阴极以碳素材料做成,在电解槽的钢板和阴极碳素材料之间还要放置耐火绝缘材料。
①主要设备——电解槽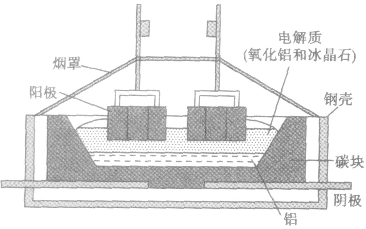
②电极反应式
阳极反应: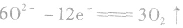
阴极反应: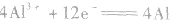
总反应:
与“已知X、Y、Z、T四种元素中,只有T不是短周期元素,与它们有关...”考查相似的试题有:
- 最近,科学家冶炼出纯度高达99.999 %的铝,你估计它具有性质是 ( )A.熔点比铁铝合金小B.在冷、浓HNO3中可以钝化C.在空...
- “天生我材必有用”,下列有关物质用途的叙述错误的是A.硝酸可用于制炸药B.氢氧化铝常用于治疗胃病C.明矾具有消毒杀菌作用,...
- 化学中常用图像直观地描述化学反应的进程或结果。下列图像描述错误的是( )A.图①表示催化剂对可逆反应2X(g)+2Y(g)3Z(g)+W(s)...
- ( 10分)有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈...
- 下列有关化学用语表示正确的是( )A.水分子的球棍模型:B.S2-的结构示意图:C.质子数为53,中子数为78的碘原子: 13153ID...
- 在下列空格中,填上适当的元素符号。(1)在第3周期中,第一电离能最小的元素是_______,第一电离能最大的元素是______。(2...
- 甲、乙是同周期的非金属元素,若原子半径甲大于乙,则下列四种叙述中正确的是( )A.最高价氧化物的水化物的酸性甲比乙强B....
- 元素周期表中部分短周期元素的位置如图所示,其中A元素最外层电子数是其电子层数的2倍.下列有关A、B、C、D、E五种元素的叙述...
- X、Y是元素周期表ⅦA族中的两种元素.下列叙述能说明X的非金属性比Y强的是( )A.X原子的电子层数比Y原子的电子层数少B.Y的...
- 同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )A.单质的化学活泼性:W<X<Y<ZB.原子最外层电子数...