本试题 “设NA代表阿伏加德罗常数的值,下列说法正确的是( )A.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个B.足量的铜与含2molH2SO4的浓硫酸充...” 主要考查您对化学反应方程式
阿伏加德罗常数
盐类水解判断溶液酸碱性或比较溶液pH值的大小
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式
- 阿伏加德罗常数
- 盐类水解判断溶液酸碱性或比较溶液pH值的大小
化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件,同时,通过相对分子质量或相对原子质量还可以表示个物质之间的质量关系,即各物质之间的质量比。
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;
二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
化学方程式的意义:
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
阿佛加德罗常数:
1mol粒子集体所含离子数与0.012kg碳12中所含的碳原子数相同,约为6.02×1023。
把1mol任何粒子的粒子数叫阿伏加德罗常数。
符号:NA,通常用6.02×1023mol-1表示
阿佛加德罗常数的单位:
阿佛加德罗常数是有单位的量,其单位是:mol-1,需特别注意。
阿佛加德罗常数的正误判断:
关于阿伏加德罗常数(NA)的考查,涉及的知识面广,灵活性强,是高考命题的热点。解答该类题目时要细心审题,特别注意题目中的关键性字词,留心“陷阱”。主要考查点如下:
1.考查“标准状况”、“常温常压”等外界条件的应用
(1)在标准状况下非气态物质:如H2O、SO3、戊烷、CHCl3、CCl4、苯、乙醇等,体积为22.4L时,其分子数不等于NA。
(2)注意给出气体体积是否在标准状况下:如11.2LH2的分子数未必是0.5NA。
(3)物质的质量、摩尔质量、微粒个数不受外界条件的影响。
2.考查物质的组成
(1)特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目:如Ne、D2O、18O2、H37Cl、—OH等。
(2)某些物质的阴阳离子个数比:如NaHSO4晶体中阴、阳离子个数比为1∶1,Na2CO3晶体中阴、阳离子个数比为1∶2。
(3)物质中所含化学键的数目:如H2O2、CnH2n+2中化学键的数目分别为3、3n+1。
(4)最简式相同的物质中的微粒数目:如NO2和N2O4,乙烯和丙烯等。
3.考察氧化还原反应中电子转移的数目
如:Na2O2、NO2与H2O的反应;Cl2与H2O、NaOH溶液、Cu或Fe的反应;电解AgNO3溶液、NaCl溶液等。
4.考查弱电解质的电离及盐的水解
如1L0.1mol/L的乙酸溶液和1L0.1mol/L的乙酸钠溶液中的CH3COO-的数目不相等且都小于0.1NA;1L0.1mol/L的NH4NO3溶液中c(NH4+)<0.1mol/L,但含氮原子总数仍为0.2NA;1molFeCl3水解生成Fe(OH)3胶粒的数目远远小于NA。
5.考查一些特殊的反应
如, 1molN2与3H2反应实际生产中得不到2molNH3,因是可逆反应;标准状况下2.24LO2和2.24LNO混合后,由于发生:2NO+O2==2NO2和
1molN2与3H2反应实际生产中得不到2molNH3,因是可逆反应;标准状况下2.24LO2和2.24LNO混合后,由于发生:2NO+O2==2NO2和![]() 两个反应,使2.24L<V<3.36L。
两个反应,使2.24L<V<3.36L。
有关NA的问题中常见的几种特殊情况:
有关NA的问题分析中易忽视如下问题而导致错误:
(1)碳原子超过4个的烃类物质、标准状况下的SO3等均不是气体,不能使用“22.4L/mol”来讨论问题。
(2)Na2O2由Na+和O22-构成,而不是由Na+和O2-构成,阴阳离子个数比为1:2而不是1:1.
(3)SiO2结构中只有原子无分子,1molSiO2中含有共价键数为4NA
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
酸式盐溶液酸碱性的判断:
酸式盐的水溶液显什么性,要看该盐的组成微粒。
1.强酸的酸式盐只电离,不水解,溶液一定显酸性。如 溶液:
溶液: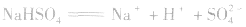
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液显碱性。例如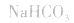 溶液中:
溶液中: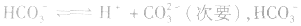
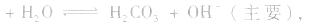
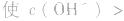
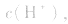 溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
(2)若电离程度大于水解程度,溶液显酸性。例如 溶液中:
溶液中: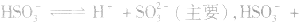
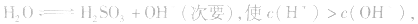 溶液显酸性
溶液显酸性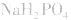 溶液亦显酸性。
溶液亦显酸性。
盐溶液蒸干后所得物质的判断:
1.考虑盐是否分解。如加热蒸干 溶液,因
溶液,因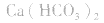 分解,所得固体应是
分解,所得固体应是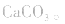
2.考虑氧化还原反应。如加热蒸干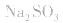 溶液,因
溶液,因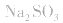 易被氧化,所得固体应是
易被氧化,所得固体应是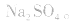
3.盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干 溶液,得
溶液,得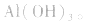 盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干
盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干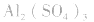 溶液,得
溶液,得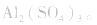
4.盐水解生成强碱时,蒸干后一般得到原物质,如蒸干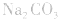 溶液,得到
溶液,得到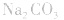 等。
等。
5.有时要多方面考虑,如加热蒸干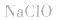 溶液时,既要考虑水解,又要考虑
溶液时,既要考虑水解,又要考虑 的分解,所得固体为
的分解,所得固体为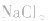
与“设NA代表阿伏加德罗常数的值,下列说法正确的是( )A.标准...”考查相似的试题有:
- 相对分子质量为106的烃完全燃烧后生成CO2和H2O的物质的量之比是( )A.4:5B.8:5C.5:8D.5:4
- NA代表阿伏加德罗常数.下列有关叙述正确的是( )A.1mol乙基(-C2H5)中含有的电子数为17NAB.标准状况下,22.4L氯仿(三氯...
- NA为阿伏加德罗常数,下列叙述中正确的是( )A.0.1molPCl3中形成共价键的电子数是0.3NAB.100mL1mol/LNaHSO4溶液中HSO4-数...
- 以NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=-1300kJ/mol的说法中,错误的是[ ]...
- A.焊接时用 NH4C1 溶液除锈B.使用泡沫灭火器时,使硫酸铝与饱和小苏打溶液混合C.饱和氯化铁溶液滴入沸水制备 Fe(OH)3胶体D...
- 室温下有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,下列说法正确的是( )A.物质的量浓度均为0.1mol/L,3种溶液pH的大...
- 25℃时,下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )A.在0.1 mol•L-1NH4Cl溶液中:c(NH4+)=c(Cl-)B.在0.1...
- 下列各组中的比值等于2:1的是( )A.pH为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比B.K2S溶液中c(K+)与c(S2-)之...
- 下列有关溶液中微粒的物质的量浓度关系正确的是A.某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)B.0....
- 草酸是二元弱酸,KHC2O4溶液呈酸性.对于0.1mol/L KHC2O4,下列关系正确的是( ) A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+...