本试题 “(14分)氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。(1)不能通过电解纯净的液态HF获得F2,其原因是 ;但电解液态KHF2时,两极分别得到F2和H2,...” 主要考查您对单质磷及其化合物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质磷及其化合物
磷在自然界中的存在:
自然界中没有游离态的磷,磷主要以磷酸盐的形式存在于矿石中。磷和氮一样,是构成蛋白质的成分之一。动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷,磷对维持生物体正常的生理机能起着重要的作用。
磷的物理性质:
磷的单质有多种同素异形体,其中常见的是白磷和红磷。白磷和红磷的主要性质如下表。 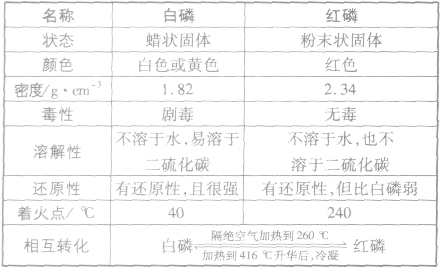
特别提醒白磷遇光会逐渐变为黄色。因此,白磷又称黄磷,白磷的颜色往往表述为“白色或黄色”。
白磷和红磷的化学性质:
白磷和红磷都能在空气或氧气中燃烧,燃烧产物一般是五氧化二磷,且反应放出大量的热,4P+5O2 2P2O5
2P2O5
磷的用途:
白磷和红磷有许多用途,如都可用于制造纯度较高的磷酸;白磷可用于制造燃烧弹、烟幕弹等;红磷可用于制农药、安全火柴等。
白磷和红磷的分子结构:
白磷的分子组成为P4,分子的空间构型为正四面体(如图A)。红磷的结构较复杂,有人认为红磷是P4分子断裂一个键后相互结合形成的长链状分子(如图B).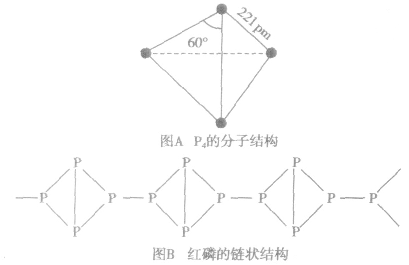
特别提醒白磷和红磷的化学式通常都写为P。
磷的化合物:
(1)五氧化二磷:
五氧化二磷的分子式为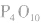 ,通常写为
,通常写为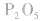 ,
,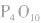 分子的空间构型如图所示。
分子的空间构型如图所示。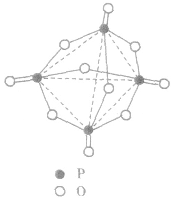
五氧化二磷通常为白色固体,由磷在空气中燃烧生成, 632K时升华。
五氧化二磷是典型的酸性氧化物,具有酸性氧化物的通性。
五氧化二磷很易跟水反应,跟冷水反应生成偏磷酸,跟热水反应生成磷酸,反应放出大量的热。 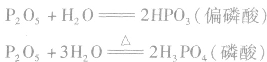
五氧化二磷的强亲水性决定了它可用作干燥剂。五氧化二磷是一种固态、酸性、无强氧化性的干燥剂,干燥能力非常强。
(2)磷酸:
磷酸为三元中强酸,属于弱电解质,易溶于水,在水中分三级电离。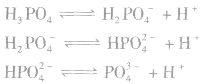
纯磷酸是无色晶体,熔点为315K.沸点较高,可溶于水。
磷酸无强氧化性,具有酸的通性。为了避免Br-、 I-被氧化,可用浓磷酸代替浓硫酸在实验室中制备HBr和HI。
(3)磷酸盐:
磷酸是三元酸,对应的盐有正盐和酸式盐: 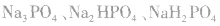 .
.
与“(14分)氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出...”考查相似的试题有:
- 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则下列有关说法中,不正确的是 ( )。A...
- 方志敏烈士生前在狱中曾用米汤(内含淀粉)给鲁迅先生写信,鲁迅先生收到信后,为了看清信中的内容,可选用的化学试剂是 ( ...
- 教材中编有较多的“资料”“阅读”“选学”内容,根据有关内容判断下列说法不正确的是( )A.玻尔用王水保存了诺贝尔奖章B.门捷列...
- 氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )A.NH4H是离子化合物,固态时属离子...
- 15L NO2和NO的混合气体通过水后收集到7L气体(同温同压),则被氧化的NO2有A.4LB.6LC.8LD.12L
- 在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO的物质的量之比为1∶3,则要使1 mol金属锌完全反应,需要硝酸的物质的量为...
- 一种无色澄清溶液可能含有K+、SO、NH、Ba2+、H2PO、NO中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉...
- 在常温常压下,将下列各组气体,等体积混合于等体积的容器中,并立即倒立于盛有水的水槽里,按试管内液面上升的高度排列正确...
- 下列实验现象描述错误的是[ ]A.红磷在空气中燃烧,产生大量白色烟雾B.将二氧化碳通入紫色石蕊溶液中,溶液变红色C.红亮的...
- 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(下图中的△H表示生成1mol产物的数据)。(1)P...