本试题 “实验室中需要22.4l(标准状况)SO2气体.化学小组同学依据化学方程式Zn+2H2SO4(浓) △ . ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g•cm-3...” 主要考查您对二氧化硫
通过实验装置图判断实验的可行性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硫
- 通过实验装置图判断实验的可行性
二氧化硫:
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的制备:
工业制法:

实验室制法:
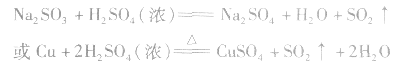
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液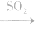 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


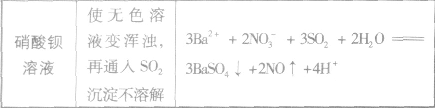
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表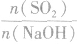 ,如下数轴所示:
,如下数轴所示: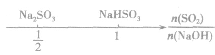
分析数轴可得:
(1)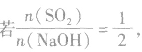 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)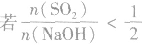 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)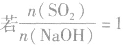 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)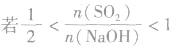 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)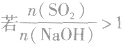 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
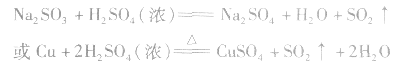
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

通过实验装置图判断实验的可行性:
1.红磷转换成白磷装置图
2.氨气易溶于水(喷泉实验)

3.氯化铵受热分解
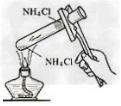
4.铵盐与碱反应
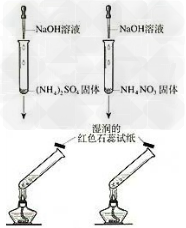
5.实验室制取氨气装置图

6.铝热反应实验装置
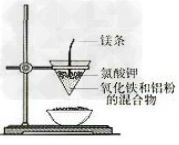
7.铁与水蒸气反应实验装置图

8.氢氧化亚铁的生成
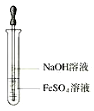
9.实验室制取乙烯的装置图
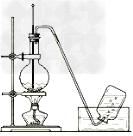
10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧
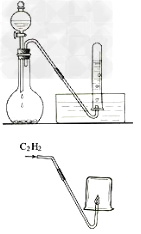
12.乙炔使溴水褪色
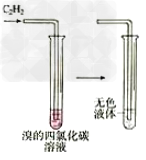
13.苯不能使高锰酸钾褪色

14.溴乙烷的水解反应
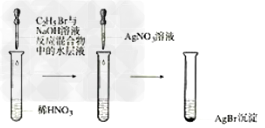
15.苯酚的显色反应
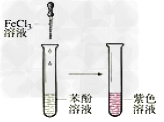
16.乙酸乙酯的制备

17.油脂的水解
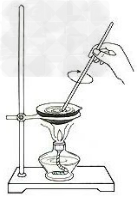
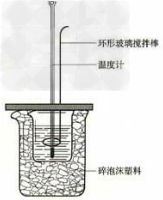
18.中和热的测定
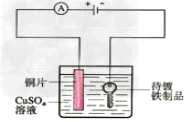
19.电镀铜实验装置
20.点解饱和食盐水
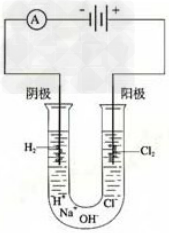
1.红磷转换成白磷装置图

2.氨气易溶于水(喷泉实验)

3.氯化铵受热分解

4.铵盐与碱反应

5.实验室制取氨气装置图

6.铝热反应实验装置

7.铁与水蒸气反应实验装置图

8.氢氧化亚铁的生成

9.实验室制取乙烯的装置图

10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧

12.乙炔使溴水褪色

13.苯不能使高锰酸钾褪色

14.溴乙烷的水解反应

15.苯酚的显色反应

16.乙酸乙酯的制备

17.油脂的水解

18.中和热的测定

19.电镀铜实验装置

20.点解饱和食盐水

发现相似题
与“实验室中需要22.4l(标准状况)SO2气体.化学小组同学依据化...”考查相似的试题有:
- 某学生课外活动小组利用下图所示装置分别做如下实验(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色...
- 一定量Cu粉与浓硫酸共热产生SO2气体体积为2.24L(标况),则下列情况不可能的是( ) A.加入铜的质量为6.4gB.加入浓硫酸中溶...
- 下列分子被称为信使分子的是[ ]A.NOB.NO2C.SO2D.CO2
- 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。(1)工业上用黄铁矿...
- 某化学兴趣小组的同学为进行物质性质的探究,用维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利滴下下图所示装置进行实验...
- 下列关于实验中颜色变化的叙述正确的是( )A.将二氧化硫通入品红溶液中,溶液显红色,加热后变为无色B.向溶液中加入新制氯...
- (1)将mg铁粉和ng硫粉均匀混合,在密闭容器中加热到红热,冷却后加入____Lbmol·L-1的盐酸就不再产生气体。若把已放出的气体...
- 已知臭氧能使湿润的KI淀粉试纸变蓝,反应的方程式为KI+O3+H2OKOH+I2+O2(未配平),下列说法正确的是( )A.O3在反应中被氧化...
- 用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是[ ]A.B.C.D.
- 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石...