本试题 “下列实验操作及现象与结论对应关系正确的一组是( )实验操作实验现象实验结论A适量二氧化碳通入氯化钡溶液中产生沉淀碳酸的酸性比盐酸弱B二氧化硫通入溴水中...” 主要考查您对二氧化硫
(浓、稀)硝酸
实验操作达到的预期目的
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硫
- (浓、稀)硝酸
- 实验操作达到的预期目的
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液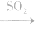 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


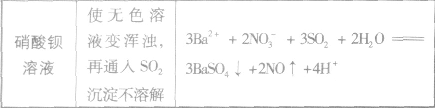
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表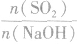 ,如下数轴所示:
,如下数轴所示: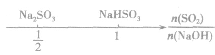
分析数轴可得:
(1)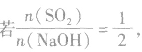 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)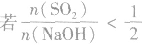 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)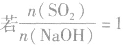 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)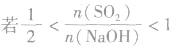 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)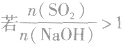 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
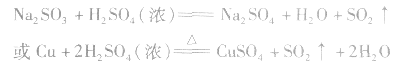
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

硝酸的分子结构:
化学式(分子式):HNO3,结构式:HO—NO2。 HNO3是由极性键形成的极性分子,故易溶于水,分子问以范德华力结合,固态时为分子晶体。
硝酸的物理性质和化学性质:
(1)物理性质:纯硝酸是无色油状液体, 开盖时有烟雾,挥发性酸[沸点低→易挥发→酸雾]
熔点:-42℃,沸点:83℃。密度:1.5 g/cm3,与水任意比互溶,98%的硝酸为发烟硝酸,69%以上的硝酸为浓硝酸。
(2)化学性质:
①具有酸的一些通性:例如: 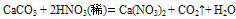 (实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
(实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
②不稳定性:HNO3见光或受热发生分解,HNO3越浓,越易分解.硝酸分解放出的NO2溶于其中而使硝酸呈黄色。有关反应的化学方程式为: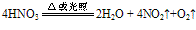
③强氧化性:不论是稀HNO3还是浓HNO3,都具有极强的氧化性,HNO3浓度越大,氧化性越强。其氧化性表现在以下几方面
A. 几乎能与所有金属(除Hg、Au外)反应。当HNO3与金属反应时,HNO3被还原的程度(即氮元素化合价降低的程度)取决于硝酸的浓度和金属单质还原性的强弱。对于同一金属单质而言,HNO3的浓度越小,HNO3被还原的程度越大,氮元素的化合价降低越多。一般反应规律为:
金属 + HNO3(浓) → 硝酸盐 + NO2↑ + H2O
金属 + HNO3(稀) → 硝酸盐 + NO↑ + H2O
较活泼的金属(如Mg、Zn等) + HNO3(极稀) → 硝酸盐 + H2O + N2O↑(或NH3等)
金属与硝酸反应的重要实例为:
①
该反应较缓慢,反应后溶液显蓝色,反应产生的无色气体遇到空气后变为红棕色(无色的NO被空气氧化为红棕色的NO2)。实验室通常用此反应制取NO气体。
②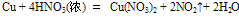
该反应较剧烈,反应过程中有红棕色气体产生。此外,随着反应的进行,硝酸的浓度渐渐变稀,反应产生的气体是NO2、NO等的混合气体。
B. 常温下,浓HNO3能将金属Fe、A1钝化,使Fe、A1的表面氧化生成一薄层致密的氧化膜。因此,可用铁或铝制容器盛放浓硝酸,但要注意密封,以防止硝酸挥发变稀后与铁、铝反应。(与浓硫酸相似)
C. 浓HNO3与浓盐酸按体积比1∶3配制而成的混合液叫王水。王水溶解金属的能力更强,能溶解金属Pt、Au。
D. 能把许多非金属单质(如C、S、P等)氧化,生成最高价含氧酸或最高价非金属氧化物。例如: 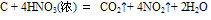
E.能氧化某些具有还原性的物质,如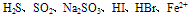 等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
(3)保存方法:硝酸易挥发,见光或受热易分解,具有强氧化性而腐蚀橡胶,因此,实验室保存硝酸时,应将硝酸盛放在带玻璃塞的棕色试剂瓶中,并贮存在黑暗且温度较低的地方。
(4)用途:硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐等。
三大强酸:
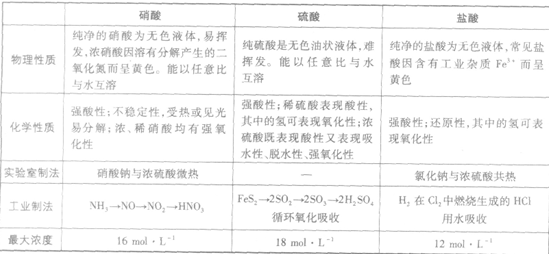
几种常见酸的比较:
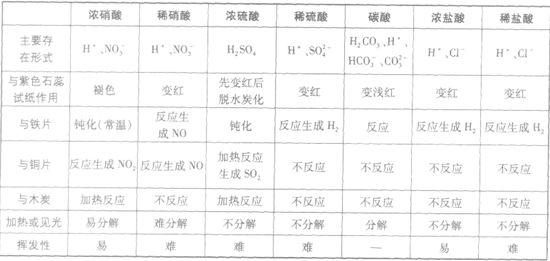
浓硝酸与稀硝酸的氧化性比较:
由铜与硝酸反应的化学方程式知,浓硝酸被还原为NO2,氮的化合价由+5→+4;而稀硝酸被还原为NO,氮的化合价由+5→+2,由此得出稀硝酸具有更强的氧化能力的结论是错误的。因为氧化剂氧化能力的强弱取决于得电子能力的强弱,而不是本身被还原的程度。实验证明,硝酸越浓,得电子的能力越强,因而其氧化能力越强。如稀硝酸能将HI氧化为I2,而浓硝酸可将HI氧化为HIO3。
硝酸在氧化还原反应中,其还原产物可能有多种价态的物质: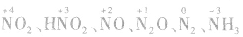 等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
浓硝酸的漂白作用:
在浓硝酸中滴入几滴紫色石蕊试液,微热,可观察到:溶液先变红后褪色,说明浓硝酸具有强氧化性,可以使某些有色物质褪色(氧化漂白)。但一般不用它作漂白剂,因为它还具有强腐蚀性。新制氯水或浓硝酸能使淀粉碘化钾试纸先变蓝后褪色,这不是因为它们的漂白性,而是因为发生了如下的化学反应: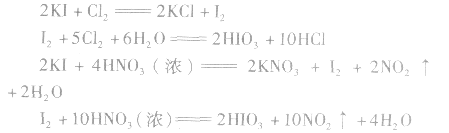
这是因为过量的氯水或硝酸又把I2氧化成了HIO3而使试纸褪色的。
另外,浓H2SO4遇湿润的蓝色石蕊试纸的现象是先变红后变黑。这是由浓H2SO4的强酸性和脱水性造成的(脱水炭化而变黑)。
(1)①用托盘天平称取5.6g氧化铜粉末(托盘天平能准确到0.1克,所以用托盘天平称取5.6g氧化铜粉末是可以的)
②用10mL水和10mL酒精配制成20mL酒精溶液(由于分子间有间隔,10mL水和10mL静静混合后体积,不能配制成20mL酒精溶液)
③用排水集气法可收集到比较纯净的氧气(收集到的气体要比排空气法收集到的气体纯,由于空气的密度与氧气的密度相差不是很大,所以排空气法收集到的气体氧气不是很纯)
④用10mL量筒量取8.2mL水(10mL量筒精确到0.1mL,所以能量取8.2mL水)
(2) ①分别加入饱和碳酸钠溶液,鉴别乙酸乙酯和乙酸(观察到有气泡产生的是乙酸,能到到鉴别的目的)
②分别加入少量金属钠,比较水和乙醇中羟基氢的活泼性(通过观察与金属钠反应的剧烈程度可以判断羟基的活泼性,能达到目的)
③分别加入浓硝酸,比较铁和铜的金属活动性(铁和铜都能和浓硝酸反应,不能达到比较金属活动性的目的)
与“下列实验操作及现象与结论对应关系正确的一组是( )实验操作...”考查相似的试题有:
- 火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,...
- 在热的稀硫酸中投入铜片,然后通入空气,实验现象为()①无明显现象,因为不发生反应②铜片溶解,溶液变蓝③铜片上有气体④铜片...
- 浓H2SO4在加热的条件下,可以和Cu等不活泼金属反应,释放出SO2气体,是因为浓H2SO4具有A.吸水性B.脱水性C.强氧化性D.强酸性
- 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确...
- 物质的量浓度相同,体积相同的下列溶液中,吸收SO2气体最多的是……( )A.NH3·H2OB.Na2CO3C.Na2SD.Ba(OH)2
- 下列叙述中正确的是[ ]A.向酸化的Ba(NO3)2溶液中通入CO2无沉淀生成,可推知向酸化的Ba(NO3)2溶液中通入SO2也无沉淀生成B.向FeI...
- 某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置.(1)实验室常选用制CO2的发生装置制SO2...
- 相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是[ ]A.浓硫酸B.稀硫酸C.浓硝酸D.稀硝酸
- 下列实验不能达到预期目的的是[ ]实验操作实验目的A.Cl2、Br2分别与H2反应 比较氯、溴的非金属性强弱B.MgCl2、AlCl3溶液中分...
- 下列各实验相应操作、实验现象及原因解释或推论合理的是( ) 选项 操作 现象 解释或推论 A 铁片投入浓硫酸 无明显变化 常温...