硫:
硫是一种非金属元素,化学符号是S,原子序数是16。单质硫是一种非常常见的无臭无味的非金属,纯的硫是黄色的晶体,又称作硫磺。
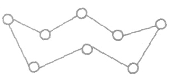
分子结构:硫元素有多种同素异形体 (由同一种元素形成的性质不同的单质)。若将硫的分子式设为 Sx,则x=1,2,3,4,5,6,7,8,9,10,12,18。Sx的分子结构可用如图表示。
硫的物理性质和化学性质:
(1)物理性质:硫为黄色晶体,俗称硫黄,质脆,易研成粉末。硫的密度比水大,不溶于水,微溶于酒精,易溶于CS。
(2)化学性质:硫位于第3周期ⅥA族,最外层有6个电子,在反应中易得到2个电子而呈-2价;硫的最高正价为+6价;单质硫的化合价为0,处于中间价态,故单质硫既有氧化性又有还原性,在反应中既可作氧化剂又可作还原剂。
如;
①弱氧化性
在加热的条件下,硫黄能被H:和绝大多数的金属单质还原。南于硫的氧化性比较弱,与变价金属反应时往往生成低价态的金属硫化物。例如:
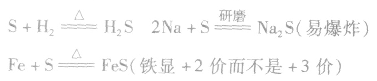

②弱还原性
在一定条件下,硫黄可被F2、O2、Cl2等非金属单质以及一些具有氧化性的化合物氧化,例如:

③硫黄在强碱溶液里加热可发生歧化反应。 (可用热碱液除去试管中残留的硫)
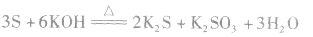
④特性:Hg、Ag在常温下不跟O2反应,但易跟S 反应。
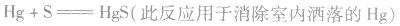
存在与用途:
存在:游离态的硫存在于火山喷口附近或地壳的岩层里,火山喷出物中含有大量含硫化合物,如H2S、 SO2、SO3等。化合态的硫主要以硫化物和硫酸盐的形式存在,如硫铁矿(FeS2)、石膏(CaSO4·2H2O)等。
用途:制H2SO4、黑火药、农药、医药和硫化橡胶。
二氧化硫:
①化学式:SO
2②分子结构:SO
2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:

(2)还原性


(3)弱氧化性

(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液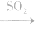 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


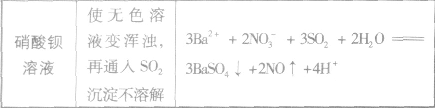
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表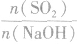 ,如下数轴所示:
,如下数轴所示:
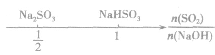
分析数轴可得:
(1)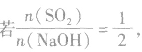 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)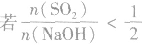 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)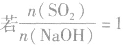 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)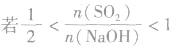 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)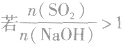 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
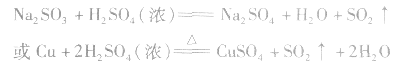
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

三氧化硫:
分子式:SO3,是含极性键的非极性分子,固态时为分子晶体。
三氧化硫的物理性质和化学性质:
1.物理性质:无色易挥发的晶体,熔点为16.8℃,沸点为44.8℃,易升华。
2.化学性质:SO3表现出酸性氧化物的通性。
(1)与水反应: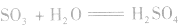 ,SO3遇水剧烈反应生成硫酸,同时放出大量的热,三氧化硫是硫酸的酸酐,又叫硫酐。
,SO3遇水剧烈反应生成硫酸,同时放出大量的热,三氧化硫是硫酸的酸酐,又叫硫酐。
(2)与碱反应:

(3)与碱性氧化物反应:
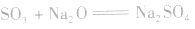
3.SO3的制法: