本试题 “现有常温下A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、Ba2+、Al3+、Cl-、Br-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成。(五种盐所含阴、阳离子...” 主要考查您对离子反应
水的电离平衡
粒子浓度大小的比较
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子反应
- 水的电离平衡
- 粒子浓度大小的比较
凡是有离子参加或离子生成的反应都是离子反应。
离子反应包括:复分解反应、氧化还原反应、络合反应、双水解反应
常见阳离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| K+ | 焰色反应 | ①铂丝在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。 | 浅紫色(通过蓝色钴玻璃片观察钾离子焰色) | —— |
| Na+ | 焰色反应 | 火焰分别呈黄色 | ||
| NH4+ | NaOH溶液(浓) | 向未知溶液中加入NaOH浓溶液并加热 | 生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体 | NH4++OH-=NH3↑+H2O |
| Al3+ | 加NaOH溶液 | 向未知溶液中加入NaOH溶液 | 加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中 |
Al3++3OH-=Al(OH)3↓ |
| Cu2+ | 浓氨水 | 向未知溶液中加入浓氨水 | 加入适量浓氨水后生成蓝色沉淀,该沉淀溶于过量浓氨水中,溶液呈深蓝色 |
Cu2++2OH-=Cu(OH)2↓ Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O |
| Ag+ | ①稀盐酸或可溶性盐酸盐②稀HNO3③氨水 | 向未知溶液中加入稀盐酸再加入稀HNO3向过滤出的沉淀中加氨水 | 生成白色沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+ | Ag++Cl-=AgCl↓ |
| Ba2+ | 稀H2SO4或可溶性酸盐溶液 | 向未知溶液中加入稀H2SO4再加入稀HNO3 | 产生白色沉淀,且沉淀不溶于稀HNO3 | Ba2++SO42-=BaSO4↓ |
| Fe3+ | KSCN溶液 | 向未知溶液中加入KSCN溶液或加NaOH溶液或加苯酚 | 变为血红色溶液 | Fe3++3SCN-=Fe(SCN)3 |
| 加NaOH溶液 | 产生红褐色沉淀 | Fe3++3OH-=Fe(OH)3↓ | ||
| 加苯酚 | 溶液显紫色 | Fe3++6C6H6OH→[Fe(C6H5O)]3-+6H+ | ||
| Fe2+ | ①加NaOH溶液 | 向未知溶液中加入NaOH溶液并露置在空气中 | 开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。 | Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| ②KMnO4 (H+)溶液 | 向未知溶液中加入KMnO4(H+)溶液 | KMnO4(H+)紫色褪去 | MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O | |
| ③K3[Fe(CN)6] | 向未知溶液中加入K3[Fe(CN)6]溶液 | 出现蓝色Fe3[Fe(CN)6]2沉淀 | 3Fe2++2[Fe(CN)6]-=Fe3[Fe(CN)6]2↓ | |
| ④KSCN溶液,新制的氯水 | 加入KSCN溶液,新制的氯水 | 加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。 | 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(SCN)3 |
常见阴离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| CO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出无色无味气体 | Ba2++CO32-=BaCO3↓ BaCO3+2H+=Ba2++CO2↑+H2O |
| ②稀盐酸、Ca(OH)2溶液 | 加入稀盐酸后放出的气体通入使澄清的Ca(OH)2溶液 | 加入稀盐酸后放出无色无味气体,通入澄清的Ca(OH)2溶液变浑浊 | CO32-+2H+=H2O+CO2↑ Ca2++2OH-+CO2=CaCO3↓+H2O | |
| SO42- | BaCl2溶液、稀硝酸或稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ba2++SO42-=BaSO4↓ |
| SO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体 | SO32-+2H+=H2O+SO2↑ |
| ②稀盐酸、品红溶液 | 加入稀盐酸后放出的气体通入品红溶液 | 加入稀盐酸后放出的气体使品红溶液褪色 | SO32-+2H+=H2O+SO2↑ | |
| Cl- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ag++Cl-=AgCl↓ |
| Br- | AgNO3溶液、稀硝酸或稀盐酸 | 生成不溶于稀硝酸或稀盐酸的浅黄色沉淀 | Ag++Br-=AgBr↓ | |
| I- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸的黄色沉淀 | Ag++I-=AgI↓ |
| ②新制氯水,淀粉溶液 | 向未知溶液中加入新制氯水,再加入淀粉溶液 | 滴入新制Cl2,振荡后再滴入淀粉溶液,变蓝 | Ag++I-=AgI↓ 2I-+Cl2=I2+2Cl- I2遇淀粉变蓝 |
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
离子浓度大小比较方法:
(1)考虑水解因素:如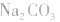 溶液
溶液 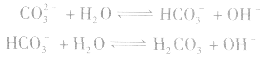
所以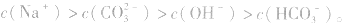
(2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的
 三种溶液中,
三种溶液中, 由大到小的顺序是c>a>b。
由大到小的顺序是c>a>b。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素。如相同浓度的 的混合液中,离子浓度顺序为:
的混合液中,离子浓度顺序为: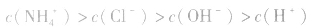
 的电离程度大于
的电离程度大于 的水解程度。
的水解程度。
盐溶液的“三大守恒”:
①电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:
推出: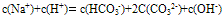
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nc(Na+):nc(C)=1:1,
推出: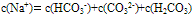
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系: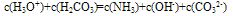
(2)粒子浓度大小比较的方法:
①单一溶液中离子浓度大小的比较
A. 一元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
如:在CH3COONa溶液中各离子浓度大小关系: 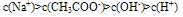
B. 二元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)> c(二级水解离子)>c(水电离出的另一离子)
如:Na2CO3溶液中离子浓度的关系: 
②比较不同电解质溶液中同一种粒子浓度的大小。应注意弱酸、弱碱电离程度的大小以及影响电离度的因素,盐类水解及水解程度对该粒子浓度的影响。
③比较经过反应化学反应后离子浓度的大小:
A. 确定电解质溶液的成分
B. 确定溶液中含哪些粒子(分子、离子),此时要考虑物质的电离和水解情况
C. 确定各种粒子的浓度或物质的量的大小
D. 根据题目要求做出判断
注:要抓住“两小”。即弱电解质电离程度小,故未电离的弱电解质分子数远多于已电离出离子数目;盐的水解程度小,故未水解的粒子数目远多于水解生成的粒子数目
与“现有常温下A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、B...”考查相似的试题有:
- 下列反应不能发生的是( )A.KCl+NaOH=NaCl+KOHB.AgNO3+NaCl=AgCl↓+NaNO3C.Na2CO3+Ca(OH)2=CaCO3↓+2NaOHD.CaCO3+H2O+CO...
- 下列反应中是离子反应,但不是氧化还原反应的是( )A.金属钠放入水中生成氢氧化钠和氢气B.金属钠在氯气中燃烧C.铁片置于...
- 室温下,甲溶液中水电离出的H+浓度为10-12mol·L-1,乙溶液中水电离出的H+浓度为10-2mol·L-1,下列说法正确的是 [ ]A.甲乙两...
- A.加水稀释,两溶液中的氢离子数目都不变B.用等浓度的NaOH溶液中和,盐酸比甲酸消耗的碱液少C.跟等质量铝粉反应,盐酸比甲...
- 下列说法正确的是A.溶液的pH值越小,溶液中含有的氢离子数就越多B.物质的水溶液浓度越高,则溶液的密度越大C.单质的化学活...
- T℃下的溶液中,c(H+) =10-xmol/L,c(OH-)=10-ymol/L,x与y的关系如图所示。下列说法不正确的是[ ]A.T℃时,水的离子积Kw为1×1...
- 下列说法正确的是( ) A.0.1mol•L-1Na2HPO4溶液中:c(Na+)+c(H+)=2c(HPO42-)+c(OH-) B.25℃时,某溶液中由水电离出...
- 常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0.5L混合溶液。(1)溶液中共有________种微粒。(2)溶液中有两种微...
- 下列有关0.1mol•L-1N如HCOw溶液中离子浓度的关系式,正确的是( )A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)B...
- 有关①100ml 0.1 mol/LNaHCO3;②100ml 0.1 mol/LNaCO3两种溶液的叙述不正确的是[ ]A.溶液中水电离出的个数:②>①B.溶液中阴离...