本试题 “苯酚具有弱酸性,在空气中易被氧化。工业上以苯、硫酸、氢氧化钠、亚硫酸钠为原料合成苯酚的方法可简单表示为:(1)根据上述反应判断下列三种物质的酸性由强...” 主要考查您对烷烃的通性
烯烃的通性
炔烃的通性
芳香烃的通式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 烷烃的通性
- 烯烃的通性
- 炔烃的通性
- 芳香烃的通式
(1)物理性质:随着分子中碳原子数的递增,熔沸点逐渐升高,相对密度逐渐增大,常温下存在状态,由气态逐渐过渡到液态、固态。
(2)烷烃的化学性质:可发生氧化、取代、分解等反应。
烷烃的氧化反应:烷烃燃烧生成二氧化碳和水。CxHy+(x+0.25y)O2
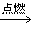 xCO2+0.5yH2O
xCO2+0.5yH2O烷烃的取代反应:烷烃在光照下可发生取代反应。CnH2n+2+Cl2
 CnH2n+1Cl+HCl
CnH2n+1Cl+HCl 烷烃的分解反应:烷烃在高温条件下能够裂解。如:C4H10
 CH2=CH2+CH3CH3
CH2=CH2+CH3CH3 烯烃的通性:
(1)物理性质:随着分子中碳原子数的递增,熔沸点逐渐升高,相对密度逐渐增大,常温下存在状态,由气态逐渐过渡到液态、固态。
(2)化学性质:烯烃可发生氧化、加成、加聚等反应。
①烯烃的氧化反应:烯烃燃烧生成二氧化碳和水。CnH2n+3n/2O2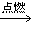 nCO2+nH2O
nCO2+nH2O
②烯烃的加成:烯烃可与氢气、卤素单质、水、卤化氢等发生加成反应。烯烃的加聚反应:以乙烯为例: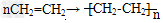 ,加聚时碳碳双键打开。
,加聚时碳碳双键打开。
③二烯烃的加成反应:以1,3-丁二烯(CH2=CH-CH=CH2)加成为例
1,2加成就是加成普通的不饱和键,和普通的烯烃和炔烃的加成一样。与氯气加成:CH2=CH-CH=CH2+Cl2→CH2Cl-CHCl-CH=CH2
1,4加成,1,4加成是分别加成两边的2个不饱和键,然后在中间重新形成一个双键。与氯气加成:CH2=CH-CH=CH2+Cl2→CH2Cl-CH=CHCH2Cl
(3)烯烃的顺反异构:根据在两个由双键连接的碳原子上所连的四个原子或基团中两个相同者的位置来决定异构体的类型。当两个相同的原子或基团处于π键平面的同侧时称“顺式异构(cis-isomerism)”;当处于π键平面的异侧时称“反式异构(trans-isomerism)”。Z表示顺,E表示反。 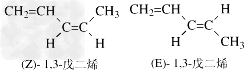
炔烃随分子碳原子数的增加,相对分子质量的增加,熔沸点逐渐升高,相对密度逐渐增大;炔烃中n≤4时,常温常压下位气态,其他未液态或固态;炔烃的相对密度一般小于水的密度;炔烃不溶于水,易溶于有机溶剂。可以发生加成反应、加聚反应、氧化反应。
烃类燃烧规律总结:
1.烃完全燃烧时的耗氧量规律
(1)等物质的量的烃(CxHy)完全燃烧时,其耗氧量的大小取决于(x+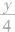 )的值,其值越大,耗氧量越大。
)的值,其值越大,耗氧量越大。
(2)等质量的烃完全燃烧时,其耗氧量的大小取决于该烃分子中氢的质量分数(或氢原子数与碳原子数的比值),其值越大,耗氧量越大。
(3)实验式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气以及燃烧后生成的二氧化碳和水的量均为定值。满足该条件的烃有C2H2和C6H6、烯烃与环烷烃等。
说明:在计算烃的衍生物的耗氧量时可将其改写成CxHy·(CO2)m·(H2O)n,耗氧量仅由CxHy 决定。
2.质量相同的烃CxHy,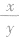 越大,生成的CO2越多; 若两种烃的
越大,生成的CO2越多; 若两种烃的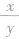 相等,则生成的CO2和H2O的质量均相等。
相等,则生成的CO2和H2O的质量均相等。
3.碳的质量分数ω(c)相同的有机物(最简式可以相同也可以不同),只要总质量一定,以任意比混合,完全燃烧后产生的CO2的量总是一个定值。
4.不同的有机物完全燃烧时,若生成的CO2和H2O的物质的量之比相同,则它们分子中C原子、H原子个数比也相同.
5.含碳量高低与燃烧现象的关系含碳量越高,燃烧现象越明显,表现在火焰越明亮.黑烟越浓,如C2H2(92.3%)、C6H6(92·3%)、C7H8 (91.3%)燃烧时火焰明亮,伴随大量浓烟;而含碳量越低,燃烧现象越不明显,往往火焰不明亮,无黑烟,如CH4(75%)就是如此;对于C2H4及其他单烯烃(均为 85.7%).燃烧时火焰较明亮,并有少量黑烟。
6.气态烃CxHy完全燃烧后生成CO2和H2O 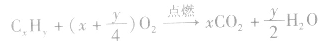
(1)当H2O为气态时(T>100℃),1L气态烃燃烧前后气体总体积的变化有以下三种情况:
当y=4时,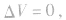 反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;
反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;
当y>4时,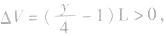 反应后气体总体积增大;
反应后气体总体积增大;
当y<4时,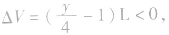 反应后气体总体积减小
反应后气体总体积减小
(2)当H2O为液态时(T<100℃),1L气态烃完全燃烧后气体总体积减小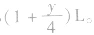
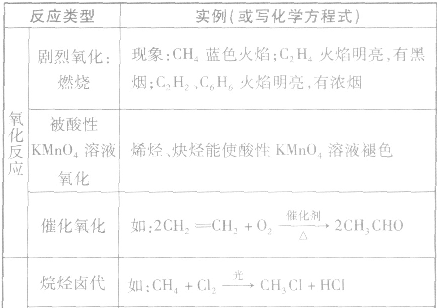
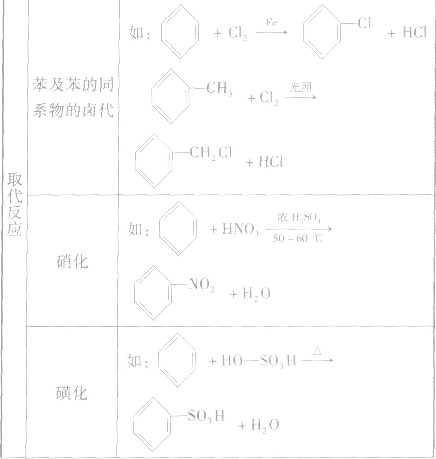
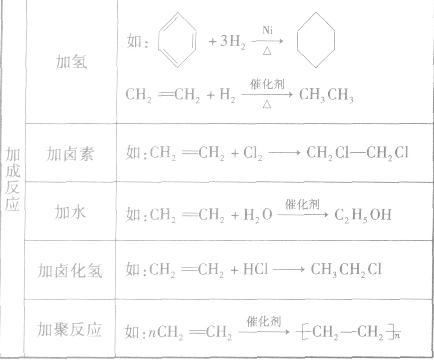
各类烃的反应类型及实例:
芳香烃的通式为CnH2n-6(n≥6)。
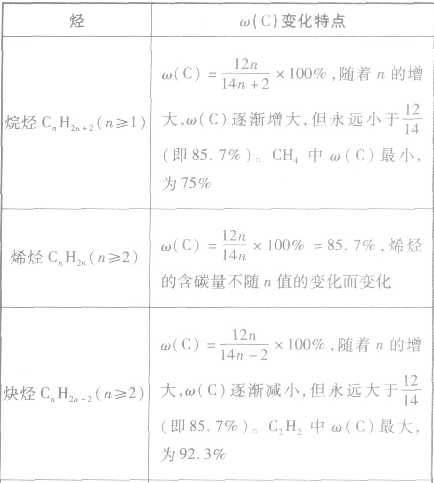
烷烃、烯烃、炔烃、苯及其同系物中碳的质量分数的变化特点:

与“苯酚具有弱酸性,在空气中易被氧化。工业上以苯、硫酸、氢氧...”考查相似的试题有:
- 某气体由氢气、一氧化碳、甲烷中的一种或几种组成。点燃该气体后,在火焰上方罩一冷而干燥的烧杯,烧杯内壁出现水雾;把烧杯...
- 以下关于甲烷的说法中错误的是A.甲烷分子具有正四面体结构B.甲烷化学性质比较稳定,不被任何氧化剂氧化C.甲烷分子中具有极...
- 下列实验能获得成功的是A.向乙酸乙酯中加入足量的30% NaOH溶液,在加热的条件下观察酯层的消失B.乙醇与浓硫酸混合,加热至1...
- 有机物:①CH2OH(CHOH)4CHO、②CH3CH2CH2OH、③CH2=CH-CH2OH、④CH2=CH-COOCH3、⑤CH2=CH-COOH中既能发生加成反应、酯化反应,又能...
- 甲苯和甘油组成的混合物中,若碳元素的质量分数为60%,那么可推断氢元素的质量分数为A.8%B.8.7%C.10%D.无法确定
- (10分)按要求填空:(1)1mol羟基的电子数是 ;(2) 的分子中含有 个手性碳原子;(3)2-甲基-1,3-丁二烯的键线式 ;(4...
- 下列有机反应中,能够实现的是A.B.C.ClCH2CH2CH3+NaOHH2O△CH3CH=CH2+NaCl+H2OD.
- 有机物的混合物,只要质量一定,无论他们按什么比例混合,完全燃烧,产生的水的质量一定的是( )A.甲苯和丙三醇B.乙醇和...
- 测定有机物中碳和氢等元素的含量,最常用的方法是燃烧分析法。即把已知量的样品置于氧气流中,用氧化铜作催化剂,在760℃左右...
- 食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185 ℃)时,会产生如下所示高毒性物质,许多疾病...