本试题 “甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:甲:取纯度相同,质量、大小相等的锌粒于两只试管中...” 主要考查您对强电解质、弱电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强电解质、弱电解质
强电解质:
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“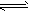 ”表示。
”表示。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
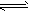 ”表示。
”表示。 强电解质和弱电解质的比较:
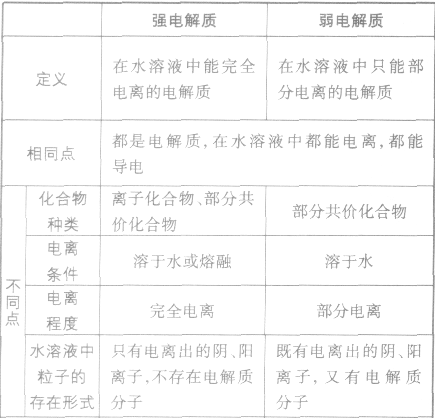
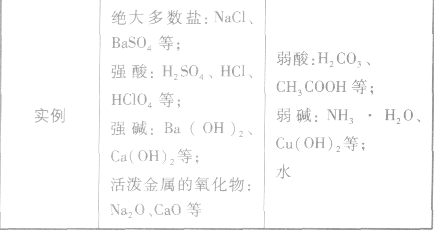
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如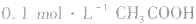 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
发现相似题
与“甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平...”考查相似的试题有:
- (10分)(1)下列物质:①H2O ②铜 ③小苏打 ④稀硫酸 ⑤CH3COOH ⑥酒精 属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是...
- A、B、C三种化合物,都是由氢、氮、氧三种元素所组成,其中一种是弱电解质,余均是强电解质.A和B可以通过复分解反应形成C....
- 下列状态的物质,既能导电又属于电解质的是A.KCl溶液B.液态HClC.熔融的NaOHD.蔗糖溶液
- 电解质溶液中,下列叙述正确的是( )A.阳离子和阴离子数目一定相等 B.阳离子带的正电荷总数一定等于阴离子所带的负电荷总...
- 离子方程式Ca2++CaCO3↓揭示了一类可溶性钙盐和可溶性碳酸盐反应的实质。请列举两例,分别以有关化学方程式表示。(1)_______...
- 下列电离方程式中,正确的是( )A.CH3COOH = CH3COO-+ H+B.KClO3K++ ClO3-C.NaOH = Na++ OH-D.NaHSO4= Na++HSO4-
- (4分)下列电解质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦Na2O;⑧K2O;⑨H2O,________________是强电解质;...
- 下面关于电解质的叙述中错误的是( )A.在水溶液里或熔融状态下能够导电的化合物叫做电解质B.电解质、非电解质都指化合物而言...
- 某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+、0.4 mol/L Clˉ,则SO42ˉ为A.0.1 mol/LB.0.2 mol/LC.0.3 mol/LD...
- 属于离子化合物的电解质(如NaCl)发生电离的条件是A.水溶液中B.熔融状态C.通直流电D.通交流电