本试题 “测试和调控溶液的PH ,对工农业生产、科学研究等有重要的意义,完成下列关于PH 的计算和比较。(1) 常温下,下列溶液中PH由大到小的顺序是_____________ 。水...” 主要考查您对强酸和弱酸的比较
水的电离平衡
溶液的酸碱性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强酸和弱酸的比较
- 水的电离平衡
- 溶液的酸碱性
强酸与弱酸(或强碱与弱碱)的比较:
1.强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质 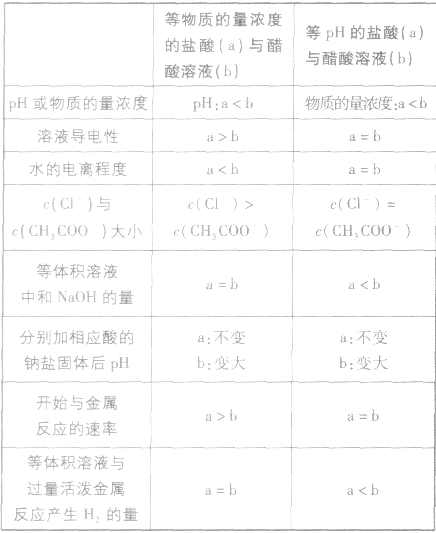
2.稀释时pH变化特点比较如下图:a、b分别为体积相等、pH相等的NaOH溶液和氨水的稀释曲线线;c、d分别为体积相等、pH相等的盐酸和醋酸溶液的稀释曲线,请体会图中的两层含义: 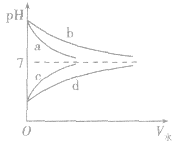
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸溶液。若稀释10n倍,盐酸、Na0H溶液pH变化n个单位,而氨水与醋酸溶液pH变化小到 n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水 >NaOH溶液,醋酸溶液>盐酸。
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
溶液的酸碱性:
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
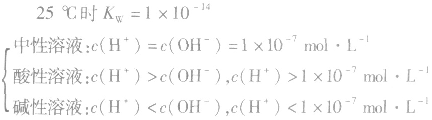
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
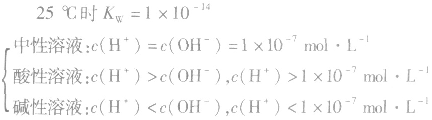
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
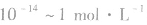 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: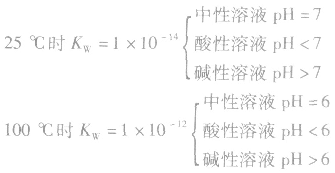
发现相似题
与“测试和调控溶液的PH ,对工农业生产、科学研究等有重要的意义...”考查相似的试题有:
- 物质的量浓度都为1mol/L的盐酸和醋酸各100 mL,分别加入5g锌粉,在相同条件下充分反应,有关叙述正确的是[ ]A.醋酸与锌反应...
- 室温下,下列各项中的比值为2:1的是[ ]A.0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比B.(NH4)2SO4溶液中c(NH4+)和c(SO...
- 下列物质加入水中,使水的电离程度增大,且所得溶液显酸性的是( )A.CH3COOHB.Al2(SO4)3C.NaOHD.Na2CO3
- (1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=__________。(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=___...
- 某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质不可能是( )A.HClB.NaOHC.NH4ClD.H2SO4
- 25℃时,水中存在电离平衡:H2O⇌H++OH-△H>0.下列叙述正确的是( )A.将水加热,Kw增大,pH不变B.向水中加入少量NaHSO4固体...
- 在50ml 0.01mol/L H2SO4溶液加入 50ml 0.01mol/LNaOH溶液时,所得溶液呈A.无法判断 B.碱性C.中性 D.酸性
- 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO2-3、HCO-3、AlO—3、Al3+离子的物质的量与加入盐酸溶液...
- 下列比较项与依据的化学反应事实不对应的是[ ]比较项依据的化学反应事实A.比较Cl和S的非金属性Na2S + 2HCl=2NaCl + H2S↑B.比...
- 向一定量某一元酸HA溶液中加入一定量强碱MOH溶液,反应后溶液呈中性,则下列判断中正确的是[ ]A.所用的酸过量B.生成的盐不...