本试题 “实验室常用加热(85℃)NH4Cl和NaNO2两种饱和溶液的方法制取N2,如图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题:【查...” 主要考查您对物质的相互转化和制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的相互转化和制备
物质的相互转化和制备:
主要是指以氧气、氢气、碳、硫、磷等为代表的非金属单质,以铝、镁、锌、铁、铜为代表的金属单质,以一氧化碳、二氧化碳等为代表的非金属氧化物,以氧化铜、氧化铁等为代表的金属氧化物,以盐酸、硫酸、碳酸等为代表的酸,以氢氧化钠、氢氧化钙等为代表的碱,以氯化钠、碳酸钠、碳酸氢钠、碳酸钙等为代表的盐,等等物质之间的相互和制备.
物质的相互转化:
氢氧化钠与氢氧化钙的制备:
(1)NaOH的制备
方法一:Na2O+H2O==2NaOH
方法二:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH
(2)Ca(OH)2的制备方法:CaO+H2O==Ca(OH)2
常见物质的相互转化:
Na→Na2O→NaOH→Na2CO3
C→CO→CO2→H2CO3
Fe→Fe2O3→Fe2(SO4)3→Fe(OH)3→FeCl3
S→SO2→SO3→H2SO4(单质硫不能直接转化为SO3)
各类物质间的转化关系:
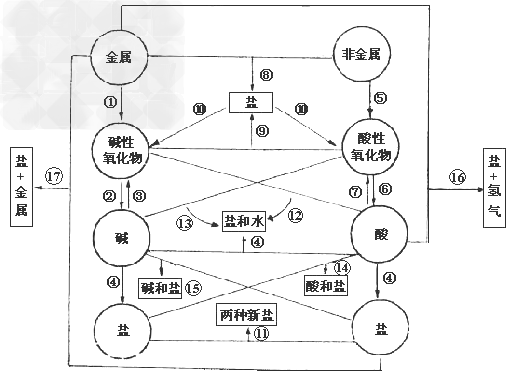
(1)金属+
 金属氧化物(碱性氧化物)
金属氧化物(碱性氧化物) 
(2)碱性氧化物(可溶)+水
 碱(可溶)
碱(可溶)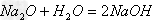
(3)碱(难溶)
 碱氧(难溶)+水
碱氧(难溶)+水 
(4)酸+碱
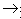 盐+水
盐+水 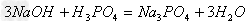 ;
;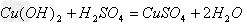
(5)非金属+
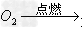 非金属氧化物(酸性氧化物)
非金属氧化物(酸性氧化物)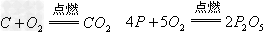
(6)酸性氧化物(易溶)+水
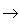 酸(易溶)
酸(易溶)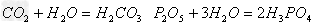
(7)酸(易挥发/难溶)
 酸氧+水(易挥发/难溶)
酸氧+水(易挥发/难溶) 
从纵向来看,金属
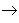 碱性氧化物
碱性氧化物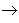 碱
碱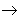 盐,其中金属元素相同。
盐,其中金属元素相同。非金属
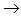 酸性氧化物
酸性氧化物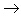 酸(含氧酸)
酸(含氧酸) 盐,其中非金属元素相同。
盐,其中非金属元素相同。横向:
(8)金属+非金属(无氧酸)
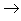 盐
盐 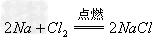
(9)碱氧+酸氧(含氧酸)
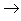 盐
盐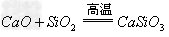
(10)含氧酸盐
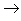 碱氧+酸氧
碱氧+酸氧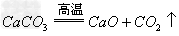
(11)盐+盐
 两种新盐
两种新盐 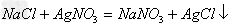
交叉:
(12)酸+碱氧
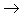 盐+水
盐+水
(13)碱+酸氧
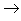 盐+水
盐+水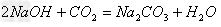
(14)酸+盐
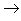 新酸+新盐
新酸+新盐 ;
;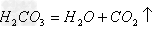
(15)碱+盐
 新碱+新盐
新碱+新盐
(16)金属+酸
 盐+
盐+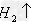
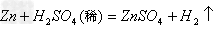
(17)金属+盐
 新盐+新金属
新盐+新金属(18)金属+盐
 新盐+新金属
新盐+新金属 (置换反应)
(置换反应) 发现相似题
与“实验室常用加热(85℃)NH4Cl和NaNO2两种饱和溶液的方法制取N2...”考查相似的试题有:
- 鉴别日常生活中的下列各组物质,两种方法均正确的是( )A.硬水和软水:滴加食盐水或加热蒸发B.甲烷和一氧化碳:滴加澄清石...
- 下列各项中括号里的物质是除去杂质所用的药品,其中错误的是A.Na0H中混有Na2CO3(盐酸)B.CO中混有CO:(烧碱溶液)C.H:...
- 现有三瓶气体,分别是氧气、空气和氮气,将一根燃着的木条分别伸入三瓶气体中,能使木条燃烧更旺的是 ________,使木条燃烧状...
- 已知下列物质间的转化,不能通过一步反应实现的是( )A.CaCO3→Ca(OH)2B.NH3→(NH4)2SO4C.Cu→Cu2(OH)2CO3D.CO2→O2
- (14分)现有一包粉末,已知它们可能由Na2SO4、CuCl2、Na2CO3、KNO3中的一种或几种组成,某学生的实验过程记录如下:(1)白...
- (6分) 金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空中技术、航海、化工、医疗上不可缺少的材料。工业...
- (10哈尔滨12).区分下列各组物质的两种方法均正确的是( )选项需区分的物质方法一方法二A过氧化氢溶液和水加二氧化锰观察颜...
- 鉴别下列物质的方法(括号内为方法)中不能达到目的的是 A.硬水和软水(加入肥皂水)B.羊毛和涤纶(灼烧)C.NH4NO4和KCl固...
- 鉴别空气、氧气、二氧化碳三瓶气体,最简单的方法是 A.将气体分别通入水中B.将气体分别通入澄清的石灰水中C.将气体分别通...
- 高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.请回答下列问题:(1)操作I的...