本试题 “已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是( )A.每生成2molH-Cl键放出431.4kJ能量B.每断裂1molH-Cl键吸收431.4kJ能量C.每断裂1molH-Cl...” 主要考查您对键能、键长、键角
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 键能、键长、键角
共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: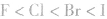
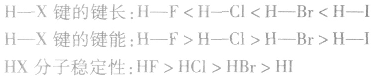
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
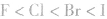
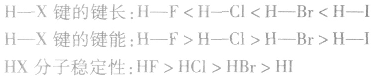
发现相似题
与“已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是...”考查相似的试题有:
- 前四周期元素X、Y、Z、W核电荷数依次增加,并且X、Y、Z的核电荷数之和为32;Y原子基态时被电子占据的轨道有9个,其中6个被电...
- 据报道,科学家用激光将置于铁室中石墨靶上的碳炸松,与此同时用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜....
- 下列说法正确的是[ ]A.在分子中,两个成键的原子间的距离叫做键长B.H-Cl的键能为431.8kJ/mol,H-I的键能为298.7kJ/mol,...
- 某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析(1)晶体中每个Y同时吸引着__________个X,每个x...
- 下列两核间距最小的离子化合物是( )A.KClB.NaFC.HFD.CaS
- (三选一)【选修3:物质结构与性质】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3...
- 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说...
- 原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知X的最外层电子数是其内层电子数的2倍;X与Y形...
- (1)已知拆开1mol H-H键、1mol I-I键、1mol H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成1mol ...
- 能用键能知识加以解释的是[ ]A.稀有气体的化学性质很不活泼B.金刚石的熔点高于晶体硅C.干冰易升华D.氮气的化学性质很稳定