本试题 “根据所学化学知识按要求将合适的答案填在横线上.(1)下列粒子中不显电性的______;①分子 ②离子 ③中子 ④质子 ⑤电子 ⑥原子(2)下列物质中属于纯净物的______...” 主要考查您对质量守恒定律
原子结构
原子的定义
构成物质的微粒(分子、原子、离子)
纯净物和混合物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 质量守恒定律
- 原子结构
- 原子的定义
- 构成物质的微粒(分子、原子、离子)
- 纯净物和混合物
质量守恒定律的概念及对概念的理解:
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
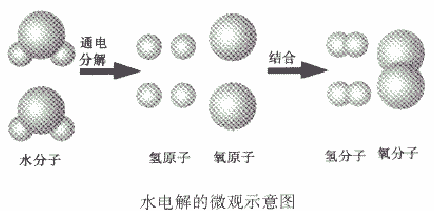
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。

质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
| 六个不变 | 宏观 | 反应前后的总质量不变 |
| 元素的种类不变 | ||
| 元素的质量不变 | ||
| 微观 | 原子的种类不变 | |
| 原子的数目不变 | ||
| 原子的质量不变 |
| 两个一定变 | 物质的种类一定变 |
| 构成物质的分子种类一定变 |
| 两个可能变 | 分子的总数可能变 |
| 元素的化合价可能变 |
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
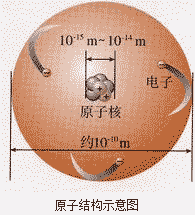
原子的构成:

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的 。
。
质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的
 。
。质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
原子结构示意图:
由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。

由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
| 项目 | 分子 | 原子 | |
| 不同点 | 本质区别 | 在化学反应中可以分成原子 | 在化学反应中不能再分 |
| 构成物质情况 | 大多数物质由分子构成 | 原子也能直接构成物质,但分子是由原子构成的 | |
| 相同点 | ①质量和体积都很小 ②都在不停地运动 ③粒子间有间隔 ④都是构成物质的粒子 ⑤同种粒子性质相同,不同种粒子性质不同 | ||
| 注意事项 | ①分子是保持物质化学性质的最小粒子 ②原子是化学变化中的最小粒子 ③分子是由原子构成的 ④对于由原子直接构成的物质,原子是保持其化学性质的最小粒子 | ||
| 联系 | 分子是由原子构成的,分子,原子都是构成物质的粒子,它们的关系是 | ||
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
分子和原子的比较:
原子与离子的比较:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 |  | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
混合物:
(1)概念:由两种或多种物质混合而成的物质,没有有固定的组成,各成分保持自己原有的化学性质。
(3)常见的混合物:空气、合金、矿石、溶液等。
(4)混合物的提纯:混合物经过物理或化学的方法可以提纯。
纯净物:
(1)概念:只由一种物质组成的物质。
(3)纯净物的分类:纯净物根据物质组成的元素种类,分为两大类:单质和化合物。
纯净物和氧化物的区别:
| 纯净物 | 混合物 | |
| 概念 | 宏观:由一种物质组成的物质 微观:由同种分子构成(对于由分子构成的物质而言) |
宏观:由两种或多种物质组成的物质 微观:由不同种分子构成(对于由分子构成的物质而言) |
| 区别 | 由同种物质组成(对于由分子构成的物质,是由同种分子构成的),组成是固定的 | 由不同种物质组成(对于由分子构成的物质. 是由不同种分子构成的),组成是不固定的 |
| 特点 | ①具有固定的组成 ②具有一定的性质 ③有专门的化学符号 |
①没有固定的组成和性质 ②各成分保持各自的性质 ③没有专门的化学符号 |
| 分离方法 | 组成固定,不需分离;若需将化合物分成几种单质,则必须通过化学方法才能实现 | 物理方法: 筛选 过滤 蒸馏 |
| 实例 | 氧气,二氧化碳,高锰酸钾 | 空气,粗盐,蔗糖水 |
| 联系 | 纯净物是相对而言的,自然界中绝对纯净的物质是不存在的,通常的纯净物是指含杂质很少的具有高纯度的物质。两者间的关系为 | |
对纯净物和混合物概念的理解:
(1)混合物概念:混合物可以看作是由几种纯净物混合而成的,混合物的形成过程中发生的是物理变化。由于混合物的组成一般不固定,所以往往不能用化学式表示。
(2)纯净物概念:纯净物只由一种物质组成,有固定的组成.可以用化学式表示。
常考的纯净物与混合物:
(1)混合物:石油、煤、天然气、洁净的空气、生理盐水、矿泉水、汽水、碘酒、白酒、双氧水、盐酸、合金等都是混合物。
(2)纯净物:水银、烧碱、纯碱、胆矾、液态氧、液态氮、蒸馏水(纯水)、干冰、冰水共存物、金刚石、石墨、生石灰、熟石灰、氯化钠、氧化铁等都是纯净物:
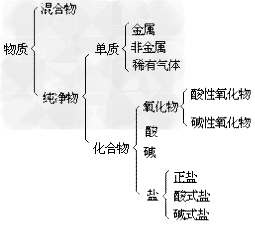
物质的分类示意图:
发现相似题
与“根据所学化学知识按要求将合适的答案填在横线上.(1)下列粒...”考查相似的试题有:
- 试设计实验证明:氯酸钾中含有氯元素和氧元素(写出实验步骤、现象和结论等).
- 实验小组的同学发现:加热铜与浓硫酸的混合物,能生成一种无色有刺激性气味的气体和蓝色溶液.(1)①某些不活泼的金属(如铜...
- 生活中处处有化学,请你用学过的化学知识回答下列问题:(1)活性炭作为家用冰箱除味剂,是因为它具有________作用。可用于洗...
- 关于化学方程式2Mg+O2 点燃 . 2MgO,四位同学表达了如下图所示的四种说法,其中错误的是( )A.B.C.D.
- 有两种微粒,它们核内总的质子数相同,对这两种微粒的叙述错误的是( )A.可能是同种元素的原子和离子B.不可能一种是分子另...
- 分别将等量的品红同时加入盛有相同体积的热水和冷水的烧杯中,观察到当热水大面积变成红色时,冷水中只有品红周围的溶液变成...
- 写出下列化学符号或符号表示的含义①2个氧原子______ ②Na+______ ③正四价的在硫元素______ ④4H2O______⑤氮分子______⑥H2______...
- 对以下实验的实验现象描述,正确的是:A.硫酸铜溶液中滴入氢氧化钠溶液,有蓝色沉淀生成B.硫在空气中燃烧发出明亮的蓝紫色...
- 生活中的下列物质属于纯净物的是[ ]A. 米酒B. 食醋C. 纯碱D. 矿泉水
- 下列物质中,属于纯净物的是A.空气B.高锰酸钾C.自来水D.石灰石