本试题 “2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太空,此次火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量...” 主要考查您对氧化剂、还原剂
氧化反应、还原反应
质量守恒定律
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 氧化反应、还原反应
- 质量守恒定律
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 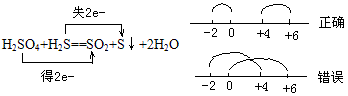
反应物中某元素失电子,化合价升高的反应过程。
还原反应(被还原):
反应物中某元素得电子,化合价降低的反应过程。
氧化反应与还原反应的关系:
氧化还原反应是氧化反应与还原反应的矛盾的统一体,两者相反相成。
氧化剂 + ne- = 还原产物
还原剂 - ne- = 氧化产物
把氧化反应和还原反应分开,是构造原电池的前提。把原电池分成氧化—还原两部分,通过导线相连,就可以使电子沿导线运动,形成电流。
质量守恒定律:
参加化学反应的各物质质量总和等于反应后生成的各物质质量总和。
化学反应前后,各种原子种类、数目、质量都不改变。
任何变化包括化学反应和核反应都不能消除物质,只是改变了物质的原有形态或结构,所以该定律又称物质不灭定律。
质量守恒定律的本质:
原子是物质质量的最小承担者。故在化学反应中,只要各种原子总数保持不变,则总质量保持不变。所以,质量守恒定律也就等价于元素守恒。
质量守恒定律的适用范围:
①质量守恒定律适用的范围是化学变化而不是物理变化;
②质量守恒定律揭示的是质量守恒而不是其他方面的守恒。物体体积不一定守恒;
③质量守恒定律中“参加反应的”不是各物质质量的简单相加,而是指真正参与了反应的那一部分质量,反应物中可能有一部分没有参与反应;
④质量守恒定律的推论:化学反应中,反应前各物质的总质量等于反应后各物质的总质量
质量守恒定律的应用:
(1)根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。利用这一定律可以解释反应前后物质的质量变化及用质量差确定某反应物或生成物的质量。
(2)根据质量守恒定律,化学反应前后元素的种类和质量不变,由此可以推断反应物或生成物的组成元素。
(3)据质量守恒定律:化学反应前后元素的种类和数目相等,推断反应物或生成物的化学式。
(4)已知某反应物或生成物质量,根据化学方程式中各物质的质量比,可求出生成物或反应物的质量。
与“2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太...”考查相似的试题有:
- 亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+离子转化为Fe3+离子,生成高铁血红蛋白而丧失与氧气结合的能力,误食亚硝酸钠中毒...
- 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X...
- 下列反应中水既不是氧化剂,又不是还原剂的氧化还原反应是[ ]A.SO3+ H2O = H2SO4B.2Na2O2+2H2O = 4NaOH + O2↑C.2F2+...
- 下列有关化学用语正确的是A.Fe的价层电子排布式是:3d64s2B.的电子排布式可简写为C.NH4Cl的电子式为D.氯离子结构示意图为:
- 有关下列三个化学反应的叙述,氧化产物和还原产物物质的量之比为2:1的是①2H2S+SO2=3S+2H2O ②S+2H2SO4(浓)=3SO2↑+ 2H2O ③...
- 某元素M形成气态单质分子M2有3种,其分子量依次为70、72、74,其物质的量之比为9:6:1,下列说法正确的是……( )A.元素M有3种...
- 以NA表示阿伏加德罗常数,下列说法中正确的是( )A.53g碳酸钠中含NA个CO32—B.0.1molOH—含NA电子C.1.8g重水(D2O)中含NA个...
- 下列各项中表达正确的是( )A.F原子结构示意图:B.H2O的电子式:C.1H、2H、3H是三种不同元素 D.乙烯的分子式: C2H4
- 下列化学用语正确的是( )A.2 -乙基-1,3-丁二烯分子的键线式:B.3-己炔的结构简式:CH3CH2CCCH2CH3C.聚丙烯的结构简式:D...
- 据报道,在我国各地发生过多次因混合洁污剂而引起氯气中毒事件,请推测,相混合的洁污剂中最有可能含有的是A.ClO-、Cl-、H...