本试题 “(1)对比同体积、同浓度的盐酸和醋酸,pH前者______后者,与碱完全中和时,消耗NaOH的物质的量是前者______后者,与足量的Zn反应产生H2的速率是前者______后...” 主要考查您对电离方程式
弱电解质的电离
溶液pH的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离方程式
- 弱电解质的电离
- 溶液pH的有关计算
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“
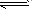 ” 。
” 。.
电离方程式的书写:
1.强电解质的电离用“ ”,弱电解质的电离用 “
”,弱电解质的电离用 “ ”。
”。
2.多元弱酸分步电离,分步持写电离方程式,一般只写第一步;多元弱碱也是分步电离的,但可按一步完全电离写出。例如:
氧硫酸: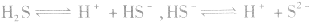
氢氧化铁:
3.强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根不完全电离。例如: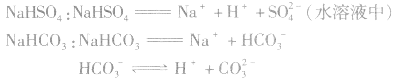
说明:在熔融状态时,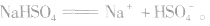
4.某些复盐能完全电离。例如:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
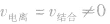 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
溶液pH的计算方法:
总体原则
(1)若溶液为酸性,先求C(H+),再求pH;
(2)若溶液为碱性,先求C(OH-),再由 ,最后求pH。
,最后求pH。
1.单一溶液pH的计算
(1)强酸溶液,如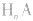 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为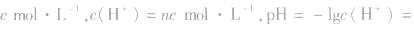
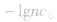
(2)强碱溶液,如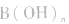 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为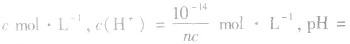
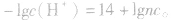
2.两强酸混合后pH的计算
由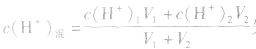 先求出混△后的
先求出混△后的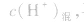 再根据公式
再根据公式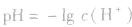 求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
3.两强碱混合后pH的计算
由 先求出混台后的
先求出混台后的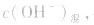 再通过
再通过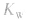 求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
4.强酸与强碱混合后pH的计算
强酸与强碱混合的实质是中和反应即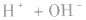
 中和后溶液的pH有以下几种情况:
中和后溶液的pH有以下几种情况:
(1)若恰好中和,pH=7。
(2)若剩余酸,先求中和后的c(H+),再求pH。
(3)若剩余碱,先求中和后的c(OH-),再通过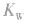 求出
求出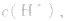 最后求pH.
最后求pH.
注意:强酸与强碱等体积混合后溶液酸碱性的判断规律:
①若二者pH之和为14,则混合后的溶液呈中性, pH=7
②若二者pH之和大于14,则混合后的溶液呈碱性
③若二者pH之和小于14,则混合后的溶液呈酸性,
5.溶液稀释后求pH
(1)对于强酸溶液,每稀释10倍体积,pH增大1 个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足一个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。
(2)对于强碱溶液,每稀释10倍体积,pH减小1 个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足一个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。
例如:pH=6的HCl溶液稀释100倍,溶液pH≈7 (不能大于7);
pH=8的NaOH溶液稀释100倍,溶液pH≈7(不能小于7):
pH=3的HCl溶液稀释100倍,溶液pH=5;
pH=10的NaOH溶液稀释100倍,溶液pH=8。
注意:弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范同。
例如:pH=3的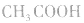 溶液稀释100倍,稀释后
溶液稀释100倍,稀释后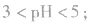
pH=10的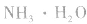 溶液稀释100倍,稀释后8<
溶液稀释100倍,稀释后8<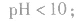
pH=3的酸溶液稀释100倍,稀释后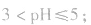
pH=10的碱溶液稀释100倍,稀释后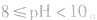
与“(1)对比同体积、同浓度的盐酸和醋酸,pH前者______后者,与...”考查相似的试题有:
- 下列电离方程式正确的是( )A.CaCl2=Ca2++Cl2‑B.Na2SO4=Na++SO42-C.HNO3=H++NO3-D.KOH=K++O2-+H+
- 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下甲:①准确配制0.1 mol...
- 关于强弱电解质的叙述正确的是:( )A.强电解质都是离子化合物,弱电解质都是共价化合物B.强电解质都是可溶性化合物,弱电...
- 下列溶液中各微粒的浓度关系不正确的是A.0.1mol/LHCOOH溶液中:c(HCOO-)+c(OH-) = c(H+)B.1L0.1 mol/LCuSO4·(NH4)2SO4·6H...
- (4分)化学上常用电离度表示电解质的相对强弱:α=已电离的电解质分子数/溶液中原有电解质的总分子数×100%。物质(微粒)及编号...
- pH相同的盐酸和醋酸两种溶液中,它们的[ ]A.H+的物质的量相同B.物质的量浓度相同C.H+的物质的量浓度不同D.H+的物质的量浓...
- 下列叙述中一定正确的是[ ]A.0.1mol/L的CH3COOH溶液中,由水电离的c(H+)为10-13mol/LB.pH=2与pH=1的CH3COOH溶液中c(H+)之...
- 下列溶液中各微粒的浓度关系正确的是( )A.0.1 mol•L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+)>c(OH-)B.0.1 mol•...
- 常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性.则下列各项正确的是( )A.混合前:c(CH3COOH)>c(NaOH)B....
- 常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,...