本试题 “将l00ml 1mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化.两份溶液中c(CO32-)的变化分别是( ...” 主要考查您对弱电解质的电离
盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质的电离
- 盐类水解的定义
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时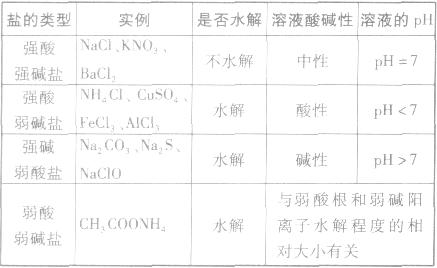
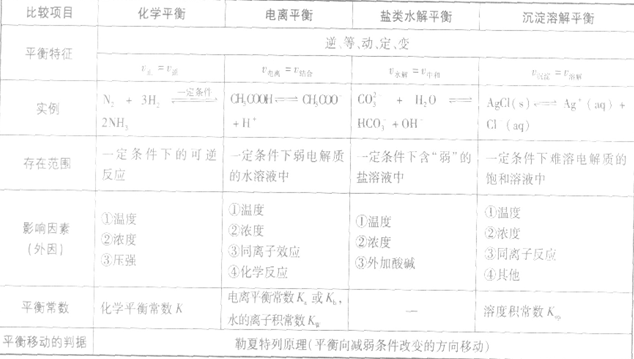
四种重要的动态平衡的比较:
发现相似题
与“将l00ml 1mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰...”考查相似的试题有:
- 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.l00mol/LNH3-H2O滴定10.00mL浓度均为0.100mol/L HC1和CH3COOH的混合...
- (1)将等质量的Zn粉分别投入:a:10 mL 0.1 mol·L-1HCl和b:10 mL 0.1 mol·L-1醋酸中。(填“>”、“=”或“<”)①若Zn不足量,则反...
- 水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过...
- 在0.1mol/L的HA溶液中存在如下电离平衡:HA⇌A-+H+,对于该溶液,下列叙述正确的是( )A.滴加少量1.0mol/L HCl溶液,平衡向...
- 常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线...
- 下列物质在常温时发生水解,对应的离子方程式正确的是( )A.Na2CO3: CO32-+2H2OH2CO3+2OH-B.NH4Cl: NH4++H2ONH3↑+H2O+H+C...
- 中学所学的A、B、C三种物质都是由H、O、S、Na中的三种元素组成的强电解质,A、B的水溶液均呈碱性,C的水溶液呈酸性。(1)测...
- 某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2AH++HA-,HA-H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列...
- 下列关于溶液中的描述正确的是A.常温时,溶液的,则该溶液中B.溶液与溶液反应至中性的离子方程式为:C.常温下物质的量浓度...
- 对下列各溶液中,微粒的物质的量浓度关系表述正确的是A.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小...