本试题 “近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:( I )将含SO2的...” 主要考查您对氧化性、还原性强弱的比较
离子方程式
二氧化硫
硝酸盐
元素化合价的求法
氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化性、还原性强弱的比较
- 离子方程式
- 二氧化硫
- 硝酸盐
- 元素化合价的求法
- 氧化还原反应的计算
用实际参加反应的离子符号表示离子反应的式子。
离子方程式书写规则:
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
离子方程式书写及正误的判断方法:
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“
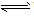 ”及状态符号“↑”和“↓”运用是否正确。
”及状态符号“↑”和“↓”运用是否正确。 强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“
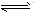 ”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。 ⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO2、SO2、H2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
⑩判断电解质在写成离子形式时阴阳离子个数比是否合理。
如Ba(OH)2溶液和稀H2SO4反应的离子方程式往往错误写成:
 ,正确为:
,正确为: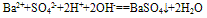
书写与量有关的离子方程式:
基本方法是:把物质的量少的物质的系数定为1,其他物质按最大量消耗。
1.因滴加顺序不同造成连续反应
- HCl与Na2CO3
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- HCl与NaAlO2
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- AlCl3与NaOH
向AlCl3溶液中滴入NaOH溶液至过量,其离子反应分步写 (1)Al3++3OH-==Al(OH)3↓ (2)Al(OH)3+OH-==AlO2-+2H2O
若向NaOH溶液中加入少量AlCl3溶液,其离子反应一步完成 Al3++4OH-==AlO2-+2H2O
若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为: Al3++3OH-==Al(OH)3↓
- AgNO3与NH3·H2O
向AgNO3溶液中滴入稀NH3·H2O至过量,其离子反应分步写(1) Ag++NH3·H2O==AgOH↓+NH4+ (2)AgOH+2NH3·H2O==Ag(NH3)2++OH-+2H2O
若向NH3·H2O溶液中加入少量AgNO3,其离子反应一步完成 Ag++3NH3·H2O==Ag(NH3)2++OH-+NH4++2H2O
若向足量AgNO3溶液中滴入少量NH3·H2O,其离子方程式为:Ag++NH3·H2O==AgOH↓+NH4+
- CO2与NaOH
向NaOH溶液中通人CO2气体至过量,其离子反应分步写 (1)2OH-+CO2==CO32-+H2O (2)CO32-+CO2+H2O==2HCO3-
若向足量NaOH溶液中通人少量CO2气体,其离子方程式为: 2OH-+CO2==CO32-+H2O
若向NaOH溶液中通人过量CO2气体,其离子反应一步完成 OH-+CO2==HCO3-
2.过量型:
向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 OH-+Ca2++HCO3-==H2O+CaCO3↓
向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-
Fe与HNO3 :铁过量时:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O
铁不足时:3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
3.定量型:
因还原性I->Fe2+>Br-,所以在FeI2或者FeBr2中通入一定量的Cl2,发生不同的离子反应,依次为:
(1)2I-+Cl2==2Cl-+I2(2)2Fe2++Cl2==2Fe3++2Cl-(3)2Br-+Cl2==2Cl-+Br2
4.目标型
向明矾溶液逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全 Al3++SO42-+Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
向明矾溶液逐滴滴加Ba(OH)2溶液至铝离子刚好沉淀完全 Al3+SO42-+Ba2++3OH-==Al(OH)3↓+2BaSO4↓
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液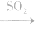 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


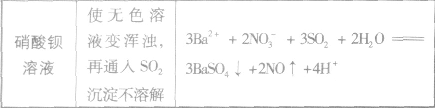
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表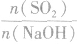 ,如下数轴所示:
,如下数轴所示: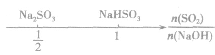
分析数轴可得:
(1)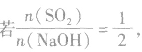 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)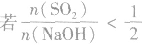 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)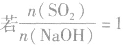 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)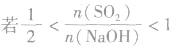 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)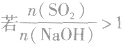 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
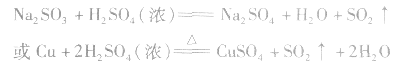
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

硝酸(HNO3)形成的盐类:
由金属离子(铵离子)和硝酸根离子组成的化合物,重要的有:硝酸钠、硝酸钾、硝酸铵、硝酸钙、硝酸铅、硝酸铈等。
硝酸盐的性质:
(1)物理性质:硝酸盐极易溶于水,大多数硝酸盐为离子型晶体,易溶于水。某些无水盐具有挥发性。易吸湿潮解。不同的硝酸盐又有其各自的特性。
(2)化学性质:
①硝酸盐加热易分解
硝酸盐分解的产物可以是:
亚硝酸盐和氧气(碱金属和碱式金属的硝酸盐);
金属氧化物和氮氧化物(镁和铜之间的硝酸盐);
金属单质(铜后金属硝酸盐)。
硝酸铵的加热分解:
在110°C时: 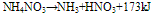
在185~200°C时: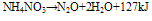
在230°C以上时,同时有弱光: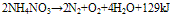
在400°C以上时,发生爆炸: 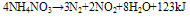
②硝酸盐在高温时是强氧化剂,但水溶液几乎没有氧化作用,但是在酸性环境中有氧化性。 如 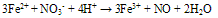
(3)储存:密封阴凉干燥保存。
(4)用途:硝酸盐多用于焰火、试剂、图像处理行业。
求化合价的原则:
在化合物中,正负化合价的代数和为0。
化合价规律:
1.在单质中,元素的化合价为0。
2.在化合物中,氢常显+1价,氧显-2价。金属元素通常显正价,非金属元素显负价。在非金属氧化物中,氧显-2价,非金属元素显正价,因而非金属元素可以有正价和负价。
3.在不同的条件下,某元素可以表现出不同的化合价
4.原子团也表现化合价,其化合价数值由构成原子的正负化合价的代数和算出。
常见元素化合价口诀:
一价氢氯钾钠银,
二价氧钙钡镁锌,
三铝、四硅、五价磷,
二三铁、二四碳,二四六硫都齐全,
氢一氧二为标准,
铜汞二价最常见,
单质价数都为零。
负一氢氧硝酸根
负二硫酸碳酸根负
三记住磷酸根
正一价的是铵根
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
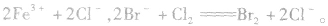 。
。
与“近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问...”考查相似的试题有:
- 已知酸性条件下有以下反应关系:①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2。②Br2能将I-氧化为I2。③KIO3能将I-氧化为I2...
- (1)按要求完成下列反应的离子方程式:(A)将一小片铜片加入稀硫酸中没有反应,再加入适量KNO3晶体,则铜片逐渐溶解,并产...
- 下列表达不正确的是( )A.NaHS在水中的电离方程式为:NaHS═Na++HS-和HS-═H++S2-B.同物质的量浓度的氨水和盐酸反应至中性时...
- 能正确表示下列化学反应的离子方程式的是( )A.氢氧化钠溶液与盐酸的反应:OH-+H+═H2OB.澄清的石灰水与稀盐酸反应:Ca(OH...
- 下列离子方程式书写正确的是( )A.铝粉投入到足量NaOH溶液中:2Al+2OH-═2AlO2-+H2↑B.AlCl3溶液中加入足量氨水:Al3++3OH-═...
- 下列离子方程式正确的是( )。A.Cl2通人FeCl2溶液中Fe3++Cl2=Fe3++2Cl-B.CaCO3溶于盐酸CO32-+2H+=C02↑+H20C.CuSO4溶液与NaO...
- 在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,___...
- (6分)现有200mL H2SO4和Na2SO4的混合溶液,其中硫酸的物质的量浓度为1 mol/L,硫酸钠的物质的量浓度为0.5mol/L。若要配制硫...
- (10分)FeS能跟盐酸反应生成H2S气体和FeCl2。把8.8FeS放入200mL2.0mol/L的盐酸中,以制备H2S。反应完全后,若溶液中H2S的浓...
- 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4...