本试题 “下列四个图象的有关说法正确的是( ) A.①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183kJ/mol B.②表示其它条件不变时,反应...” 主要考查您对碳酸钠
碳酸氢钠
焓变、反应热
化学反应的限度
弱电解质的电离
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳酸钠
- 碳酸氢钠
- 焓变、反应热
- 化学反应的限度
- 弱电解质的电离
碳酸钠(Na2CO3):
(1)俗名:纯碱或苏打;白色粉末,易溶于水,稳定;可用于制玻璃、肥皂、造纸、防治等
(2)与H+反应:CO32-+2H+==CO2↑+H2O
(3)与NaOH不反应
(4)与石灰水反应:CO32-+Ca2+==CaCO3↓
(5)与氯化钡反应:CO32-+Ba2+==BaCO3↓
(6)与CO2反应:CO32-+CO2+H2O==2HCO3-
碳酸钠的物理性质:
碳酸钠常温下为白色粉末或颗粒。溶于水和甘油,不溶于乙醇。水溶液呈强碱性,pH11.6。
碳酸钠是一种强碱盐,溶于水后发生水解反应(碳酸钠水解会产生碳酸氢钠和氢氧化钠),使溶液显碱性,有一定的腐蚀性,能与酸进行复分解反应。
稳定性 稳定性较强,但高温下也可分解,生成氧化钠和二氧化碳。长期暴露在空气中能吸收空气中的水分及二氧化碳,生成碳酸氢钠,并结成硬块。吸湿性很强,很容易结成硬块,在高温下也不分解。含有结晶水的碳酸钠有3种:Na2CO3·H2O、Na2CO3·7H2O和Na2CO3·10H2O。
碳酸钠的用途:
用于制玻璃、肥皂、造纸、纺织等工业,也用作食品工业发酵剂。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
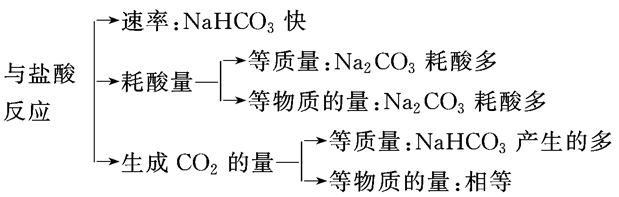
Na2CO3溶液与盐酸反应:
滴加顺序不同,现象不同,化学方程式不同。
①向盐酸里逐滴加入Na2CO3溶液(开始时酸过量) 2HCl+Na2CO3===2NaCl+CO2↑+H2O
②向Na2CO3溶液里逐滴加入盐酸(开始时酸不足) HCl+Na2CO3==NaCl+NaHCO3(无气泡) HCl+NaHCO3==NaCl+CO2↑+H2O(后来有气泡)
[特别提醒]
(1)Na2CO3和盐酸可以用互滴法鉴别。
(2)滴加顺序不同,放出CO2的量可能相同,也可能不同。
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。
碳酸氢钠(NaHCO3):
(1)俗名:小苏打;细小白色晶体,溶解度小于Na2CO3,受热易分解,可用于治疗胃酸过多、发酵剂
(2)与H+反应:HCO3-+H+==CO2↑+H2O
(3)与NaOH反应:HCO3-+OH-==CO32-+H2O
(4)与石灰水反应:生成CaCO3沉淀
(5)与BaCl2和CO2不反应
碳酸氢钠的物理性质:
碳酸氢钠为白色晶体,或不透明单斜晶系细微结晶。比重2.15g。无臭、味咸,可溶于水,不溶于乙醇。其水溶液因水解而呈微碱性,常温中性质稳定,受热易分解,在50℃以上迅速分解,在270℃时完全失去二氧化碳,在干燥空气中无变化,在潮湿空气中缓慢分解。溶解度:7.8g,18℃;16.0g,60℃。
碳酸氢钠的用途:
碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:

碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。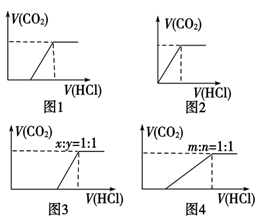
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
与“下列四个图象的有关说法正确的是( ) A.①表示化学反应H2(g...”考查相似的试题有:
- 为减小和消除过量CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。(1)最近有...
- 甲醇是一种可再生能源,具有开发和应用的广阔前景。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g...
- 下列说法中,正确的是( )A.熵减的吸热反应可能是自发反应B.已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨稳定C....
- 在一定温度下的2L密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,n(O2)随时间的变化如...
- 常温下,将0.01 mol·L-1Na2SO3溶液与0.01 mol·L-1KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量...
- 强弱电解质的本质区别是 ( ) A.导电能力B.相对分子质量C.电离程度D.溶解度
- 下列事实可证明氨水是弱碱的是[ ]A.氨水能与H2SO4反应生成(NH4)2SO4B.铵盐受热易分解C.0.1mol/L的氨水可使酚酞试液变红D...
- 25℃时,水的电离达到平衡:H2O⇌H++OH-,下列叙述正确的是( )A.向水中加入少量固体NaCl,平衡逆向移动,c(OH-)降低B.向...
- 下列四组实验中现象或结论不正确的是实验现象结论A.热水中平衡球颜色比冷水中深升温,化学平衡向吸热反应方向移动B.起始时产...
- 液氨与水的电离相似,存在关微弱的电离:2NH3+NH3NH4++NH2—。对该体系的说法中错误的是 ( )A.液氨中c(NH4+)与c(NH2—)的乘...