本试题 ““农夫X”天然矿泉水的主要成份可用如下,请认真阅读后填空.主要成分(mg/L):碳酸氢根(HCO3-):173-205 氯离子(Cl-):1.0-8.0 __________(SO42-):16....” 主要考查您对硬水和软水
节约用水
物质组成元素的质量分数
溶液的酸碱性与pH值
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 硬水和软水
- 节约用水
- 物质组成元素的质量分数
- 溶液的酸碱性与pH值
定义:
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
定义:
是指通过行政、技术、经济等管理手段加强用水管理,调整用水结构,改进用水方式,科学、合理、有计划、有重点的用水,提高水的利用率,避免水资源的浪费。特别要在全民中做好宣传,利用世界水日等节水活动,教育每个人都在日常工作或生活中科学用水,自觉节水,达到节约用水人人有责。
节水用水从我做起:
1.洗菜、淘米的水用来浇花、拖地、冲厕所
2.使用节水龙头,
3.水龙头坏了立即进行修理
4.用喷灌、滴灌方法给农作物浇水
5.沐浴擦香皂是暂时关上喷头
节水徽记:

A图是2000年以前酬锹勺节水徽记。
B图为新千年“国家节水标志”。“标志”由水滴、人手和地球组成。
是指通过行政、技术、经济等管理手段加强用水管理,调整用水结构,改进用水方式,科学、合理、有计划、有重点的用水,提高水的利用率,避免水资源的浪费。特别要在全民中做好宣传,利用世界水日等节水活动,教育每个人都在日常工作或生活中科学用水,自觉节水,达到节约用水人人有责。
节水用水从我做起:
1.洗菜、淘米的水用来浇花、拖地、冲厕所
2.使用节水龙头,
3.水龙头坏了立即进行修理
4.用喷灌、滴灌方法给农作物浇水
5.沐浴擦香皂是暂时关上喷头
节水徽记:

A图是2000年以前酬锹勺节水徽记。
B图为新千年“国家节水标志”。“标志”由水滴、人手和地球组成。
定义:
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=
如AmBn中A元素的质量分数=
若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=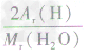 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成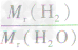 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%
化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例: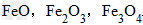 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
解析:三种含铁的氧化物的化学式可变形为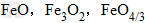 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: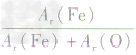 、
、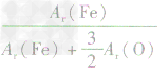 、
、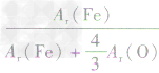 ,通过比较分母可知:
,通过比较分母可知: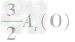 >
>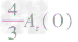 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=

如AmBn中A元素的质量分数=

若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=
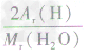 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成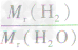 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例:
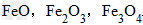 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?解析:三种含铁的氧化物的化学式可变形为
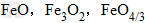 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: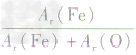 、
、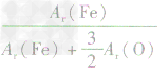 、
、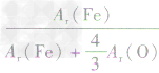 ,通过比较分母可知:
,通过比较分母可知: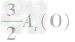 >
>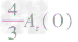 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。溶液的酸碱度及表示方法
1. 溶液的酸碱性:溶液呈酸性、碱性或中性,通常用指示剂来测定。
2. 溶液的酸碱度:指溶液酸碱性的强弱程度,即酸碱度是定量表示溶液酸碱性强弱的一种方法.溶液的酸碱度通常用pH表示。
3. pH的范围:0—14
溶液酸碱度和pH值的关系
| 溶液的pH值 | 溶液的酸碱度 |
| <7 | 酸性溶液(pH越小,酸性越强) |
| =7 | 中性溶液 |
| >7 | 碱性溶液(pH越大,碱性越大) |
(2)粗略测定溶液的酸碱度常用pH试纸。
pH的测定方法:
测定溶液pH通常用pH试纸和pH计。其中用pH试纸测定溶液pH的具体操作为:测定时,将pH试纸放在表面皿上,用干净的玻璃棒蘸取被测溶液并滴在pH试纸上,半分钟后把试纸显示的颜色与标准比色卡对照,读出溶液的pH,简记为:“一放、二蘸、三滴、四比”。
改变溶液pH的方法:
溶液的pH实质是溶液中H+浓度或OH-浓度大小的外在表现。改变溶液中H+浓度或OH-浓度,溶液的pH就会发生改变。
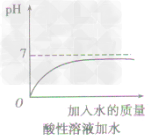
方法一加水:只能改变溶液的酸碱度,不能改变溶液的酸碱性,即溶液的pH只能无限地接近于7。
①向酸性溶液中加水,pH由小变大并接近7,但不会等于7,更不会大于7(如下图所示)。
②向碱性溶液中加水,pH由大变小并接近于7,但不会等于7,更不会小于7(如下图所示)。

方法二加酸碱性相同,pH不同的溶液:原溶液酸碱性不会发生变化,但混合后溶液的pH介于两种溶液之间:
方法三加酸碱性相反的溶液:混合后发生中和反应,溶液的pH可能等于7,若加入的溶液过量,原溶液的酸碱性就会与原来相反(如下图所示)。

pH值测定时的注意事项:
①不能直接把pH试纸浸入待测的溶液中,以免带入杂质,同时还可能溶解pH试纸上的一部分指示剂,致使比色时产生较大误差。
②不能先用水将pH试纸润湿再进行测定。因为将待测溶液滴到用水润湿后的pH试纸上,其溶质质量分数将变小。
③用pH试纸测得溶液的pH一般为整数。
了解溶液的酸碱度的重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中.农作物一般适宜在pH为7或接近于7的土壤中生长;
③测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
身边一些物质的pH:

发现相似题
与““农夫X”天然矿泉水的主要成份可用如下,请认真阅读后填空.主...”考查相似的试题有:
- 每年3月22日是“世界水日”,下列有关水的叙述正确的是( )A.经常饮用蒸馏水对身体有益B.可用肥皂水区别硬水和软水C.所有物...
- 水是生命之源,下列关于水的说法正确的是( )A.淡水是取之不尽、用之不竭的B.电解水生成的氢气和氧气的体积比约为1:2C....
- 供城市生活用水的自来水厂净水流程如下图所示,请填空:(1)取水口处的水常呈浑浊,是因为水中含有许多 ;(2)加絮凝剂的目的是...
- 下列区别物质的方法错误的是( )A.用肥皂水区别软水和硬水B.用水区别氯化钠和硝酸铵固体C.用燃烧的方法区别羊毛和涤纶D....
- 2009年2月江苏省某市市民在饮用自来水时闻到刺鼻的农药味。经检测,该市城西自来水厂的水源受到某化工厂排放的酚类化合物的污...
- 酒精(C2H5OH)的某种水溶液,溶质和溶剂中氢原子个数相等,则该溶液中溶质的质量分数为 ( )A.23%B.46%C.55%D.72%
- 近年来,乳酸成为人们研究的热点之一,它在医药、食品等行业中有广阔的应用前景,乳酸的化学式为C3H6O3.试计算:(1)乳酸中...
- 乙烯(C2H4)是石油炼制的重要产物之一。常温常压时,乙烯是一种气体,它与另一种气体组成的混合物中碳元素的质量分数为87%,...
- 2003年5月20日,深圳发生了举国震惊的特大投毒案.犯罪分子使用的是一种名叫“毒鼠强”的剧毒鼠药(化学式为C4H8O4N4S2).下列...
- 黄瓜富含维生素C,维生素C在PH<5的环境中较稳定,为减少维生素C的损失,在食用黄瓜时加入少量的[ ]A.食醋B.纯碱C.白糖D.食盐