本试题 “下列物质中,不具有还原性的是( )A.H2B.CO2C.COD.C” 主要考查您对一氧化碳还原氧化铜
氢气还原氧化铜
木炭还原氧化铜
碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 一氧化碳还原氧化铜
- 氢气还原氧化铜
- 木炭还原氧化铜
- 碳的性质
氧化铜自身具有氧化性,我们可以用一氧化碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
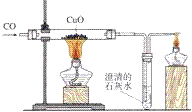
一氧化碳还原氧化铜的实验:
1. 实验器材
铁架台、酒精灯(也可以是酒精喷灯)、试管、导管、双孔橡皮塞、单孔橡皮塞。 药品有:氧化铜、澄清石灰水、一氧化碳
2. 化学反应
CO与CuO反应的化学方程式为: CO+ 2CuO
 2Cu + CO2
2Cu + CO2 CO2与Ca(OH)2(澄清石灰水)反应的化学方程式: Ca(OH)2+CO2=CaCO3↓+H2O
3. 反应现象
①黑色固体变成红色②导管口有气泡冒出③澄清石灰水变浑浊
4. 实验步骤
(1)连接装置
(2)检查装置的气密性。
(3)点燃加热尾气的酒精灯。
(4)通入CO,排除串联装置中的空气。
(5)加热CuO。
(6)停止加热CuO。
(7)通入CO,排净残留在串联装置中的空气。
(8)停止点燃尾气。
注:①先通入CO一会儿,是为了防止玻璃管内的空气没有排尽,加热时发生爆炸。
②继续通入CO到玻璃管冷却为止,是为了防止生成的铜重新被氧化为氧化铜、防止澄清石灰水倒流。
总之:"CO早出晚归,酒精灯迟到早退",也说“先通后点防爆炸,先熄后停防氧化。”
③用酒精灯点燃是进行尾气处理:防止一氧化碳污染空气,使人中毒。
注:此试验应在通风橱中进行:防止没除净的CO使人中毒。
5. 装置:
氧化铜自身具有氧化性,我们可以用氢气还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
氢气还原氧化铜实验:
| 原理 | H2+CuO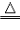 H2O+Cu H2O+Cu |
| 装置 |  |
| 步骤 | ①先通氢气(直到盛氧化铜的试管内充满纯净的氢气) ②后点燃洒精灯加热 ③先熄灭洒精灯停止加热(当出现明显的实验现象后) ④后停止通氢气(等试管冷却后再停止) 简单记忆为“氢气早来晚走,酒精灯迟到早退” |
| 现象 | ①黑色氧化铜变成光亮红色 ②试管口处有小水珠 |
| 注意事项 | ①通氢气的导管必须伸入试管底部,保证与氧化铜充分反应 ②必须先通氢气后加热,否则可能会发生爆炸 ③停止加热后必须等试竹冷却后再停止通氢气,否则铜可能会重新被氧化 |
实验总结顺口溜:
氢气验纯试管倾
先通氢气后点灯
黑色变红水珠出
熄灭灯后再停氢
氧化铜自身具有氧化性,我们可以用碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
木炭还原氧化铜实验:
1.原理:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
2.装置: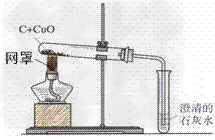
3.现象:
①黑色粉末变成红色;
②澄清石灰水变浑浊
4.步骤:①装药品;②固定试管,连接装置;③加热;④撤出导管;⑤熄灭酒精灯
5.注意:
①要先撤导管再扯酒精灯,防止水倒吸。
②要充分加热木炭和氧化铜粉末,除去其中水分。
③研磨混合要充分。
④加热温度要足够,最好使用酒精喷灯或煤气灯
概述:
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2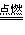 CO2
CO2
氧气不充分的条件下:2C+O2 2CO
2CO
3.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2 CO2
CO2
氧气量不充足时,碳不充分燃烧:2C+O2 2CO
2CO
mg碳与ng氧气反应:
①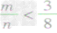 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;
②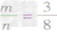 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2;
③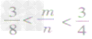 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;
④ 时,恰好完全反应生成CO;
时,恰好完全反应生成CO;
⑤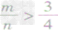 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。
碳单质及其化合物间的转化:
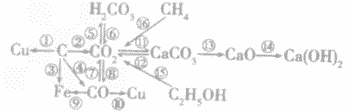
(1)C+2CuO 2Cu+CO2↑
2Cu+CO2↑
(2)C+O2 CO2
CO2
(3)3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
(4)2C+O2 2CO
2CO
(5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2 2CO2
2CO2
(8)C+CO2 2CO
2CO
(9)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(10)CO+ 2CuO 2Cu + CO2
2Cu + CO2
(11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3 CaO+CO2
CaO+CO2
(14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
(16)CH4+O2 CO2+2H2O
CO2+2H2O
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2
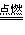 CO2
CO2 氧气不充分的条件下:2C+O2
 2CO
2CO 3.还原性:
木炭还原氧化铜:C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O4
 3Fe+2CO2↑
3Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2
 CO
CO 碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2
 CO2
CO2 氧气量不充足时,碳不充分燃烧:2C+O2
 2CO
2CO mg碳与ng氧气反应:
①
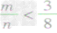 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;②
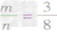 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2; ③
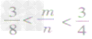 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;④
 时,恰好完全反应生成CO;
时,恰好完全反应生成CO; ⑤
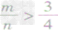 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。 碳单质及其化合物间的转化:

(1)C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ (2)C+O2
 CO2
CO2(3)3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ (4)2C+O2
 2CO
2CO (5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2
 2CO2
2CO2 (8)C+CO2
 2CO
2CO(9)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 (10)CO+ 2CuO
 2Cu + CO2
2Cu + CO2 (11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3
 CaO+CO2
CaO+CO2 (14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O(16)CH4+O2
 CO2+2H2O
CO2+2H2O 发现相似题
与“下列物质中,不具有还原性的是( )A.H2B.CO2C.COD.C”考查相似的试题有:
- 用纯净的CO还原CuO时,试管中的CuO由_______色逐渐变为_______色;将生成的气体通入澄清的石灰水中,可以看到澄清的石灰水___...
- 某化学研究性学习小组的同学做了如下图所示的探究实验。实验发现CO与CuO加热后黑色粉末变成红色粉末。请你参与该小组的研究过...
- 某大理石粉末样品中可能混有少量锌粉,为了证明CO与CuO在加热条件下能发生反应,并确认原样品中是否含有锌粉,有同学利用如下...
- 向红热的木炭中通入硫的蒸气,能发生反应生成一种叫二硫化碳的物质,推断这个反应的方程式为______.
- 碳纤维是一种强度比钢大,密度比铝小,比不锈钢耐腐蚀,比耐热钢耐高温,又像铜那样导电,具有许多宝贵的电学、热学和力学性...
- 下列都是含有铜元素的化学方程式,其中不能反应的是[ ]A.Cu+2AgNO3=Cu(NO3)2+2AgB.CuO+2HCl=CuCl2+H2OC.C+2CuO=2Cu+CO2D....
- 阅读材料,回答问题:2008年9月25日至28日,中国成功实施了神州七号载人航天飞行,创下了中国航天史上的新纪元,全国上下为之...
- 下列物质中,既有可燃性又有还原性的单质是( )A.COB.O2C.CD.CO2
- 碳和氢气在化学性质上不具有的相似点是[ ]A.都有氧化性B.都有还原性C.都有可燃性D.常温下稳定
- 2013年3月,浙江大学高分子系高超教授的课题组将含有石墨烯(石墨烯由石墨制成)和碳纳米管两种纳米材料的水溶液在低温环境下...