本试题 “以下实验操作正确的是______A.向酒精灯里添加酒精时,酒精的量一般加到酒精灯容积的14~23间B.加热氯酸钾制氧气,用排水法收集,实验完毕后先撤导气管,后...” 主要考查您对加热器皿—酒精灯
过滤
氧气的制取和收集
一氧化碳还原氧化铜
氢气还原氧化铜
木炭还原氧化铜
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 加热器皿—酒精灯
- 过滤
- 氧气的制取和收集
- 一氧化碳还原氧化铜
- 氢气还原氧化铜
- 木炭还原氧化铜
酒精灯:
是以酒精为燃料的加热工具,用于加热物体。酒精灯由灯体、灯芯管和灯帽组成。酒精灯的加热温度400—500℃,适用于温度不需太高的实验,特别是在没有煤气设备时经常使用。
以酒精灯酒精灯酒精(乙醇,C2H5OH)为燃料的加热工具,用于加热物体。

酒精灯
组成:
酒精灯由灯壶、灯芯、灯芯管、酒精和灯帽组成。
酒精灯的加热温度400—600℃,适用于温度不需太高的实验,特别是在没有煤气设备时经常使用。
酒精灯的容积:100ml,150ml。
(1)酒精灯是由灯帽、灯芯和盛有酒精的灯壶三大部分所组成。
(2)正常使用的酒精灯火焰应分为焰心、内焰和外焰三部分。加热时应用外焰加热。近年来的研究表明:酒精灯火焰温度的高低顺序为:内焰>外焰>焰心。理论上一般认为酒精灯的外焰温度最高,由于外焰与外界大气充分接触,燃烧时与环境的能量交换最容易,热量释放最多,致使外焰温度高于内焰。
(3)若要灯焰平稳,并适当提高温度可加金属网罩;金属网罩可用废旧的铁窗纱自制。
主要用途:
(1)作为热源灯具;
(2)进行焰色反应。
使用方法:
(1)新购置的酒精灯应首先配置灯芯。灯芯通常是用多股棉纱线拧在一起,插进灯芯瓷套管中。灯芯不要太短,一般浸入酒精后还要长4—5cm。
对于旧灯,特别是长时间未用的灯,在取下灯帽后,应提起灯芯瓷套管,用洗耳球或嘴轻轻地向灯内吹一下,以赶走其中聚集的酒精蒸气。再放下套管检查灯芯,若灯芯不齐或烧焦都应用剪刀修整为平头等长。
(2)新灯或旧灯壶内酒精少于其容积1/4的都应添加酒精。酒精不能装得太满,以不超过灯壶容积的3/4为宜。(酒精量太少则灯壶中酒精蒸气过多,易引起爆燃;酒精量太多则受热膨胀,易使酒精溢出,发生事故。)添加酒精时一定要借助个小漏斗,以免将酒精洒出。燃着的酒精灯,若需添加酒精,必须熄灭火焰。决不允许燃着时加酒精,否则,很易着火,造成事故。万一洒出的酒精在桌上燃烧起来,要立即用湿棉布铺盖灭。用完酒精灯,火焰必需用灯帽盖灭,不可用嘴吹灭,以免引起灯内酒精燃烧,发生危险。
(3)新灯加完酒精后须将新灯芯放入酒精中浸泡,而且移动灯芯套管使每端灯芯都浸透,然后调好其长度,才能点燃。因为未浸过酒精的灯芯,一经点燃就会烧焦。
(4)点燃酒精灯一定要用燃着的火柴,决不能用一盏酒精灯去点燃另一盏酒精灯。否则易将酒精洒出,引起火灾。
(5)加热时若无特殊要求,一般用温度最高的外焰来加热器具。加热的器具与灯焰的距离要合适,过高或过低都不正确。与灯焰的距离通常用灯的垫木或铁环的高低来调节。被加热的器具必须放在支撑物(三脚架、铁环等)上或用坩埚钳、试管夹夹持,决不允许手拿仪器加热。
(6)熄灭酒精灯:加热完毕或要添加酒精需熄灭灯焰时,可用灯帽将其盖灭,如果是玻璃灯帽,盖灭后需再重盖一次,放走酒精蒸汽,让空气进入,免得冷却后盖内造成负压使盖打不开;如果是塑料灯帽,则不用盖两次,因为塑料灯帽的密封性不好。决不允许用嘴吹灭。
不用的酒精灯必须将灯帽罩上,以免酒精挥发,因为酒精灯中的酒精,不是纯酒精,所以挥发后,会有水在灯芯上,致使酒精灯无法点燃。
(7)酒精灯不用时,应盖上灯帽。如长期不用,灯内的酒精应倒出,以免挥发;同时在灯帽与灯颈之间应夹小纸条,以防粘连。
(8)要用酒精灯的外焰加热,给玻璃仪器加热时应把仪器外壁擦干否则仪器炸裂,给试管中的药品加热,首先必须预热,然后在对着药品部位加热。加热时不能让试管接触灯芯,否则试管会炸裂。
物质加热:
使用酒精灯时,先要检查灯芯,如果灯芯顶端不平或已烧焦,需要剪去少使其平整,然后检查灯里有无酒精,灯里酒精的体积应大于酒精灯容积的1/4,少于2/3。在使用酒精灯时,应注意,绝对禁止用酒精灯引烧另一盏酒精灯,而应用燃着的火柴或木条来引燃;用完酒精灯,必须用灯帽盖灭{要盖两下},不可用嘴去吹灭,否则可能将火焰沿灯颈压入灯内,引起着火或爆炸。不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,不要惊慌,应立即用湿抹布扑盖。酒精灯灯焰分外焰、内焰、焰心三部分,在给物质加热时,应用外焰加热,因为外焰温度最高。注意:
(1)在用酒精灯加热可以用试管、烧瓶、烧杯、蒸发皿来给液体加热,在加热固体时可用干燥的试管、蒸发皿等,有些仪器如集气瓶、量筒、漏斗等不允许用酒精灯加热。(烧杯、烧瓶不可直接放在火焰上加热,应放在石棉网上加热)
(2)如果被加热的玻璃容器外壁有水,应在加热前擦拭干净,然后加热,以免容器炸裂。
(3)加热的时候,不要使玻璃容器的底部跟灯芯接触,也不要离得很远,距离过近或过远都会影响加热效果,烧得很热的玻璃容器,不要立即用冷水冲洗,否则可能破裂,也不要立即放在实验台上,以免烫坏实验台。
(4)给试管里的固体加热,应行进行预热,预热的方法是:在火焰上来回移动试管,对已固定的试管,可移动酒精灯,待试管均匀受热后,再把灯焰固定在放固体的部位加热。
(5)给试管里的液体加热,也要进行预热。同时注意液体体积最好不要超过试管体积1/3,加热时,使试管斜一定角度(45°左右),在加热时要不时地移动试管,为避免试管里的液体沸腾喷出伤人,加热时切不可将试管口朝着自己和有人的方向,试管夹应夹在试管的中上部,手应该持试管夹的长柄部分,以免大拇指将短柄按下,造成试管脱落。
(6)特别注意在夹持时应该从试管底部往上套,撤除时也应该由试管底部撤出。
使用注意事项:
(1)不能在燃着酒精灯时添加酒精,酒精量不超其容积的2/3,也不能少于1/4。
(2)严禁用燃着的酒精灯去点燃,用酒精灯的外焰加热物质。
(3)熄灭时用灯帽盖灭,灯要斜着盖住,否则有危险。
(4)不用时盖好灯帽,以免酒精挥发。
(5)不能用燃着的酒精灯去点燃另一个酒精灯,防止酒精溢出,发生火灾。
安全指南:
因为酒精易挥发,易燃,使用酒精灯时必须注意安全。万一洒出的酒精在灯外燃烧,不要慌张,可用湿抹布或砂土扑灭。
是以酒精为燃料的加热工具,用于加热物体。酒精灯由灯体、灯芯管和灯帽组成。酒精灯的加热温度400—500℃,适用于温度不需太高的实验,特别是在没有煤气设备时经常使用。
以酒精灯酒精灯酒精(乙醇,C2H5OH)为燃料的加热工具,用于加热物体。

酒精灯
组成:
酒精灯由灯壶、灯芯、灯芯管、酒精和灯帽组成。
酒精灯的加热温度400—600℃,适用于温度不需太高的实验,特别是在没有煤气设备时经常使用。
酒精灯的容积:100ml,150ml。
(1)酒精灯是由灯帽、灯芯和盛有酒精的灯壶三大部分所组成。
(2)正常使用的酒精灯火焰应分为焰心、内焰和外焰三部分。加热时应用外焰加热。近年来的研究表明:酒精灯火焰温度的高低顺序为:内焰>外焰>焰心。理论上一般认为酒精灯的外焰温度最高,由于外焰与外界大气充分接触,燃烧时与环境的能量交换最容易,热量释放最多,致使外焰温度高于内焰。
(3)若要灯焰平稳,并适当提高温度可加金属网罩;金属网罩可用废旧的铁窗纱自制。
主要用途:
(1)作为热源灯具;
(2)进行焰色反应。
使用方法:
(1)新购置的酒精灯应首先配置灯芯。灯芯通常是用多股棉纱线拧在一起,插进灯芯瓷套管中。灯芯不要太短,一般浸入酒精后还要长4—5cm。
对于旧灯,特别是长时间未用的灯,在取下灯帽后,应提起灯芯瓷套管,用洗耳球或嘴轻轻地向灯内吹一下,以赶走其中聚集的酒精蒸气。再放下套管检查灯芯,若灯芯不齐或烧焦都应用剪刀修整为平头等长。
(2)新灯或旧灯壶内酒精少于其容积1/4的都应添加酒精。酒精不能装得太满,以不超过灯壶容积的3/4为宜。(酒精量太少则灯壶中酒精蒸气过多,易引起爆燃;酒精量太多则受热膨胀,易使酒精溢出,发生事故。)添加酒精时一定要借助个小漏斗,以免将酒精洒出。燃着的酒精灯,若需添加酒精,必须熄灭火焰。决不允许燃着时加酒精,否则,很易着火,造成事故。万一洒出的酒精在桌上燃烧起来,要立即用湿棉布铺盖灭。用完酒精灯,火焰必需用灯帽盖灭,不可用嘴吹灭,以免引起灯内酒精燃烧,发生危险。
(3)新灯加完酒精后须将新灯芯放入酒精中浸泡,而且移动灯芯套管使每端灯芯都浸透,然后调好其长度,才能点燃。因为未浸过酒精的灯芯,一经点燃就会烧焦。
(4)点燃酒精灯一定要用燃着的火柴,决不能用一盏酒精灯去点燃另一盏酒精灯。否则易将酒精洒出,引起火灾。
(5)加热时若无特殊要求,一般用温度最高的外焰来加热器具。加热的器具与灯焰的距离要合适,过高或过低都不正确。与灯焰的距离通常用灯的垫木或铁环的高低来调节。被加热的器具必须放在支撑物(三脚架、铁环等)上或用坩埚钳、试管夹夹持,决不允许手拿仪器加热。
(6)熄灭酒精灯:加热完毕或要添加酒精需熄灭灯焰时,可用灯帽将其盖灭,如果是玻璃灯帽,盖灭后需再重盖一次,放走酒精蒸汽,让空气进入,免得冷却后盖内造成负压使盖打不开;如果是塑料灯帽,则不用盖两次,因为塑料灯帽的密封性不好。决不允许用嘴吹灭。
不用的酒精灯必须将灯帽罩上,以免酒精挥发,因为酒精灯中的酒精,不是纯酒精,所以挥发后,会有水在灯芯上,致使酒精灯无法点燃。
(7)酒精灯不用时,应盖上灯帽。如长期不用,灯内的酒精应倒出,以免挥发;同时在灯帽与灯颈之间应夹小纸条,以防粘连。
(8)要用酒精灯的外焰加热,给玻璃仪器加热时应把仪器外壁擦干否则仪器炸裂,给试管中的药品加热,首先必须预热,然后在对着药品部位加热。加热时不能让试管接触灯芯,否则试管会炸裂。
物质加热:
使用酒精灯时,先要检查灯芯,如果灯芯顶端不平或已烧焦,需要剪去少使其平整,然后检查灯里有无酒精,灯里酒精的体积应大于酒精灯容积的1/4,少于2/3。在使用酒精灯时,应注意,绝对禁止用酒精灯引烧另一盏酒精灯,而应用燃着的火柴或木条来引燃;用完酒精灯,必须用灯帽盖灭{要盖两下},不可用嘴去吹灭,否则可能将火焰沿灯颈压入灯内,引起着火或爆炸。不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,不要惊慌,应立即用湿抹布扑盖。酒精灯灯焰分外焰、内焰、焰心三部分,在给物质加热时,应用外焰加热,因为外焰温度最高。注意:
(1)在用酒精灯加热可以用试管、烧瓶、烧杯、蒸发皿来给液体加热,在加热固体时可用干燥的试管、蒸发皿等,有些仪器如集气瓶、量筒、漏斗等不允许用酒精灯加热。(烧杯、烧瓶不可直接放在火焰上加热,应放在石棉网上加热)
(2)如果被加热的玻璃容器外壁有水,应在加热前擦拭干净,然后加热,以免容器炸裂。
(3)加热的时候,不要使玻璃容器的底部跟灯芯接触,也不要离得很远,距离过近或过远都会影响加热效果,烧得很热的玻璃容器,不要立即用冷水冲洗,否则可能破裂,也不要立即放在实验台上,以免烫坏实验台。
(4)给试管里的固体加热,应行进行预热,预热的方法是:在火焰上来回移动试管,对已固定的试管,可移动酒精灯,待试管均匀受热后,再把灯焰固定在放固体的部位加热。
(5)给试管里的液体加热,也要进行预热。同时注意液体体积最好不要超过试管体积1/3,加热时,使试管斜一定角度(45°左右),在加热时要不时地移动试管,为避免试管里的液体沸腾喷出伤人,加热时切不可将试管口朝着自己和有人的方向,试管夹应夹在试管的中上部,手应该持试管夹的长柄部分,以免大拇指将短柄按下,造成试管脱落。
(6)特别注意在夹持时应该从试管底部往上套,撤除时也应该由试管底部撤出。
使用注意事项:
(1)不能在燃着酒精灯时添加酒精,酒精量不超其容积的2/3,也不能少于1/4。
(2)严禁用燃着的酒精灯去点燃,用酒精灯的外焰加热物质。
(3)熄灭时用灯帽盖灭,灯要斜着盖住,否则有危险。
(4)不用时盖好灯帽,以免酒精挥发。
(5)不能用燃着的酒精灯去点燃另一个酒精灯,防止酒精溢出,发生火灾。
安全指南:
因为酒精易挥发,易燃,使用酒精灯时必须注意安全。万一洒出的酒精在灯外燃烧,不要慌张,可用湿抹布或砂土扑灭。
过滤定义:
利用介质滤除水中杂质的方法。
通过特殊装置将流体提纯净化的过程,过滤的方式很多,使用的物系也很广泛,固-液、固-气、大颗粒、小颗粒都很常见。
在推动力或者其他外力作用下悬浮液(或含固体颗粒发热气体)中的液体(或气体)透过介质,固体颗粒及其他物质被过滤介质截留,从而使固体及其他物质与液体(或气体)分离的操作。
过滤归纳:
| 过滤的原理 | 其中一种能溶于水,另一种不能溶于水,则可以先把它们充分溶于水中,再进行过滤分离 |
| 制作过滤器 | 把一张圆形滤纸连续对折两次,得到一个四层的扇形滤纸,然后再用手捏住最外面一层滤纸展开,便得到一个一边是一层,另一边是三层的滤纸,用少量水润湿一下,把它贴在漏斗内壁上即可。 |
| 用到的仪器 | 铁架台(带铁圈)、烧杯、漏斗、玻璃棒、滤纸等 |
| 过滤装置 | 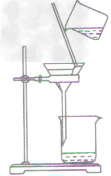 |
| 注意事项 | 操作注意事项有:一贴、二低、三靠。 一贴:滤纸紧贴漏斗内壁,以没有气泡为准,可加快过滤的速度; 二低:滤纸边缘低于漏斗边缘;漏斗内液面低于滤纸边缘,防止液体从滤纸与漏斗之间的间隙流下,使过滤不充分; 三靠:盛待过滤液体的烧杯紧靠引流的玻璃棒,防止液体溅到漏斗外丽;玻璃棒的下端紧靠在三层滤纸上,防止戳破滤纸;漏斗下端长的那侧管口紧靠烧杯内壁,防止液体溅出 |
| 过滤失败的原因 | ①滤纸破损;②过滤时液面高于滤纸边缘; ③收集滤液的烧杯不洁净 |
| 过滤操作实验口诀 | 斗架烧杯玻璃棒,滤纸漏斗角一样。 过滤之前要静置,三靠两低不要忘。 |
氧气的制取是初中化学的重点,也是历年中考的热点。我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。中考对制取氧气的考查主要集中在药品选用、实验装置、操作步骤等方面。
实验室制取收集氧气:
| 过氧化氢制氧气 | 高锰酸钾制氧气 | |
| 药品和反应原理 | 2H2O2 2H2O+O2↑ 2H2O+O2↑ |
2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| 发生装置 | 固液常温型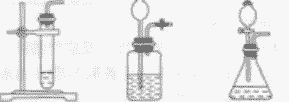 |
固体加热型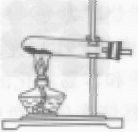 |
| 收集装置 | 氧气可用排水法收集,也可用向上排空气法收集 | |
| 整体装置图 | 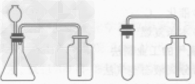 |
 |
| 操作步骤 | ①检查装置气密性 ②再锥形瓶中装入二氧化锰 ③塞好带有长颈漏斗和导管的橡皮塞(长颈漏斗的下端一定在液面以下,否则氧气会从长颈漏斗中跑出来) ④向长颈漏斗中加入过氧化氢溶液 ⑤收集氧气 |
①检查装置气密性 ②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花) ③将试管固定在铁架台上 ④点燃酒精灯,预热后加热试管 ⑤当导管口有连续均匀的气泡冒出时开始收集气体 ⑥收集完毕,先将导管移出水面 ⑦熄灭酒精灯。加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。可用谐音记忆为“茶庄定点收利息”。 |
| 注意事项 | ①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。 ②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。 ③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。 ④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。 |
①药品要平铺在试管底部,均匀受热。 ②试管口要略向下倾斜,防止药品中湿存的水分受热后变成水蒸气,遇冷凝结成水倒流回试管底部,使试管炸裂。 ③铁架台的铁夹要夹在试管的中上部(或距离试管口1/3处)。 ④试管内的导管稍伸出橡皮塞即可,这样便于气体导出。 ⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。 ⑥加热时要先使试管均匀受热,然后酒精灯外焰要对准药品所在部位加热。 ⑦用排水法收集气体时,应注意当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有大盆气泡冒出时,证明已集满。 ⑧停止加热时,应先把导管从水里撤出,再撤掉酒精灯。如果先熄灭酒精灯,试管内气体温度降低,压强减小,水槽中的水就会被倒吸入热的试管内,使试管炸裂。 ⑨用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾小颗粒进人导管。 ⑩盛氧气的集气瓶应盖上玻璃片正放,因为在相同状况下氧气的密度大于空气的密度,正放可减少气体的逸散。 |
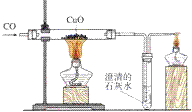
氧化铜自身具有氧化性,我们可以用一氧化碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
一氧化碳还原氧化铜的实验:
1. 实验器材
铁架台、酒精灯(也可以是酒精喷灯)、试管、导管、双孔橡皮塞、单孔橡皮塞。 药品有:氧化铜、澄清石灰水、一氧化碳
2. 化学反应
CO与CuO反应的化学方程式为: CO+ 2CuO
 2Cu + CO2
2Cu + CO2 CO2与Ca(OH)2(澄清石灰水)反应的化学方程式: Ca(OH)2+CO2=CaCO3↓+H2O
3. 反应现象
①黑色固体变成红色②导管口有气泡冒出③澄清石灰水变浑浊
4. 实验步骤
(1)连接装置
(2)检查装置的气密性。
(3)点燃加热尾气的酒精灯。
(4)通入CO,排除串联装置中的空气。
(5)加热CuO。
(6)停止加热CuO。
(7)通入CO,排净残留在串联装置中的空气。
(8)停止点燃尾气。
注:①先通入CO一会儿,是为了防止玻璃管内的空气没有排尽,加热时发生爆炸。
②继续通入CO到玻璃管冷却为止,是为了防止生成的铜重新被氧化为氧化铜、防止澄清石灰水倒流。
总之:"CO早出晚归,酒精灯迟到早退",也说“先通后点防爆炸,先熄后停防氧化。”
③用酒精灯点燃是进行尾气处理:防止一氧化碳污染空气,使人中毒。
注:此试验应在通风橱中进行:防止没除净的CO使人中毒。
5. 装置:
氧化铜自身具有氧化性,我们可以用氢气还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
氢气还原氧化铜实验:
| 原理 | H2+CuO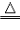 H2O+Cu H2O+Cu |
| 装置 |  |
| 步骤 | ①先通氢气(直到盛氧化铜的试管内充满纯净的氢气) ②后点燃洒精灯加热 ③先熄灭洒精灯停止加热(当出现明显的实验现象后) ④后停止通氢气(等试管冷却后再停止) 简单记忆为“氢气早来晚走,酒精灯迟到早退” |
| 现象 | ①黑色氧化铜变成光亮红色 ②试管口处有小水珠 |
| 注意事项 | ①通氢气的导管必须伸入试管底部,保证与氧化铜充分反应 ②必须先通氢气后加热,否则可能会发生爆炸 ③停止加热后必须等试竹冷却后再停止通氢气,否则铜可能会重新被氧化 |
实验总结顺口溜:
氢气验纯试管倾
先通氢气后点灯
黑色变红水珠出
熄灭灯后再停氢
氧化铜自身具有氧化性,我们可以用碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
木炭还原氧化铜实验:
1.原理:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
2.装置: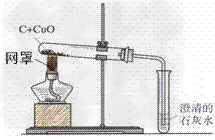
3.现象:
①黑色粉末变成红色;
②澄清石灰水变浑浊
4.步骤:①装药品;②固定试管,连接装置;③加热;④撤出导管;⑤熄灭酒精灯
5.注意:
①要先撤导管再扯酒精灯,防止水倒吸。
②要充分加热木炭和氧化铜粉末,除去其中水分。
③研磨混合要充分。
④加热温度要足够,最好使用酒精喷灯或煤气灯
发现相似题
与“以下实验操作正确的是______A.向酒精灯里添加酒精时,酒精的...”考查相似的试题有:
- 某同学用量筒量取液体,初次仰视读数是19毫升,倒出部分液体后再俯视读数是11毫升,则该同学倾出的液体是A.8毫升B.大于8毫...
- 下列实验探究的结论错误的是( )A.空气中含量最多的气体是稀有气体B.酒精灯火焰的外焰温度最高C.浓硫酸溶于水时溶液的温...
- 根据实验规范,图示的实验操作中正确的是( )A.B.C.D.
- (5分)下图所示为实验室常用的实验装置:据此回答下列问题:(1)实验室制取和收集CO2时应选用 两种装置相连接,检验集气瓶...
- 生活在密闭狭小的特殊环境(如潜艇、太空舱)里,氧气会越来越少,二氧化碳会越来越多,因此将二氧化碳转化为氧气,不仅有科...
- 实验小组用下图的装置进行实验.实 验 步 骤简 答第一步:称取3g氯酸钾与少量二氧化锰混合后放入装置①的试管中,点燃酒精灯....
- 下列制取和收集气体的方法正确认识( )A.用铜和稀硫酸反应制取氢气B.用向上排空气法收集氢气C.用KClO3和MnO2共热制取O2D...
- C三的一位同学根据所学知识设计了下列物质的区别方法,您认为错误的是( )A.区别氧气和氮气,选择带火星的木条B.区别二氧...
- 要使下图装置中的小气球鼓起来,实验时使用的固体和液体应该是:①铁粉和食醋②石灰石和盐酸③氯化钠和水④氧化钙和水[ ]A.①②③B.①...
- (2011年浙江金华,28题)下图是实验室用于制取、干燥和收集气体的装置图。实验课上同学们用过氧化氢溶液和二氧化锰制取并收...