本试题 “右图是a、b两种固体物质的溶解度曲线.下列说法正确的是( )A.b物质的溶解度大于a物质的溶解度B.t2℃时,100克b物质的溶液中含有80克b物质C.t1℃时,a、b两...” 主要考查您对饱和溶液,不饱和溶液
固体溶解度
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 饱和溶液,不饱和溶液
- 固体溶解度
饱和溶液和不饱和溶液的概念:
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液 不饱和溶液
不饱和溶液
(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水 不饱和石灰水
不饱和石灰水
概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)
溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液 饱和溶液
饱和溶液
溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)
溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液 不饱和溶液
不饱和溶液
溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
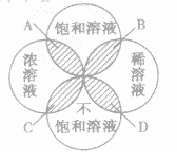 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液
 不饱和溶液
不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水
 不饱和石灰水
不饱和石灰水概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液
 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液
 饱和溶液
饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液
 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液
 不饱和溶液
不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
概念:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
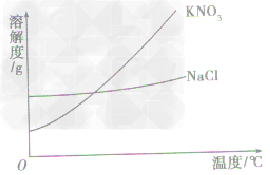
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
发现相似题
与“右图是a、b两种固体物质的溶解度曲线.下列说法正确的是( )...”考查相似的试题有:
- 现有t℃时两瓶硝酸钾溶液,其中一瓶是饱和溶液(溶质质量分数为50%).另一瓶溶质质量分数为10%的溶液.下列操作无法将这两种...
- x、y两物质(不含结晶水)溶解度曲线如图所示,在t2℃时分别往两份100g水中加入a克x和a克y充分搅拌后,将溶液均降温至t1℃,下...
- 下图是a、b、c三种物质的溶解度曲线,下列说法不正确的是A.在t2℃时,a的溶解度等于b的溶解度B.在t1℃时,a、c的饱和溶液的溶...
- 右图是a、b、c三种物质的溶解度曲线.下列说法中正确的是( )A.三种物质的溶解度都随温度的升高而增大B.t2℃时a的溶解度等...
- 已知25℃时硝酸钾的溶解度是36.0g.某同学在50g水中加入了16g硝酸钾,搅拌,使硝酸钾全部溶解,得到______ g溶液.要使该溶液...
- 如图表示M、N两种不含结晶水的固体物质的溶解度曲线.根据图示判断,下列说法中,正确的是( )A.M、N的溶解度都随温度的升...
- (1)汽油与酒精分别加入蒸馏水中,能形成溶液的是____________。(2)白糖固体放人口中有清凉的感觉。请从溶解现象推测其可能的...
- 如图是A、B、C三种物质的溶解度曲线,请据图回答:(1)t1℃时,A物质的溶解度为______g;(2)t2℃时,将A、B、C三种物质的饱...
- 如图所示,是甲、乙、丙三种固体物质的溶解度曲线.下列说法正确的是( )A.t℃时,甲、乙、丙三种物质的饱和溶液的质量分数...
- (1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母) ____(A.地壳中金属元...