本试题 “氢气是未来的理想能源,科学家正在探究光分解水制取氢气反应的催化剂,下列有关说法正确的是( )A.氢气燃烧要放出大量的热能,其他物质燃烧没有热能放出B....” 主要考查您对氢气的验纯
氢气的用途
催化剂和催化作用
化学式的写法和意义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氢气的验纯
- 氢气的用途
- 催化剂和催化作用
- 化学式的写法和意义
验纯
验纯就是化学中检验所的产物的纯度,验纯一般是确保化学实验的安全。
例如,点燃氢气前要验纯,氢气是一种可燃性气体,它的爆炸极限是在与氧气混合4%到74.2%时,如果不验纯,就不知道集气瓶内有没有掺杂的氧气,就容易爆炸。
检验氢气纯度的方法:
实验用品:
酒精灯,铁架台,大试管,干燥的小试管,长颈漏斗,锌粒,稀硫酸。
实验步骤:
1. 用稀硫酸和锌粒制取氢气,用向下排空气法收集氢气。
2. 用大拇指捂住小试管。
3. 点燃洒精灯,试管移近火焰,试管口对着燃着的洒精灯火焰,移开拇指点火。
4. 如听到尖锐的爆鸣声,说明氢气不纯。
5. 如爆鸣声轻而沉闷,说明试管内收集的氢气纯净。
说明:
如果第一次检验的氢气不纯,需再次检纯时,必须用拇指捂住试管口一段时间,使试管内没有燃尽的氢气火焰完全熄灭,方可再次收集氢气,否则易发生仪器爆炸事故。
注意:
必须听到轻微的 “噗”声,才能说明氢气纯度比较高。刚开始收集的气体,大多是发生器里的空气,检验时不会发出声响。把这样的气体当成纯净的氢气使用,点燃时可能会发生爆炸。如果用向下排空气法收集氢气,经检验不纯而需要再检验时,收集前,必须用拇折堵住试管口一会儿,使试管内尚未熄灭的氢气火焰因缺氧而熄火,然后再收集气体检验纯度,否则,试管中没有熄灭的氢气火焰就会点燃氢气发生器里尚混有空气的氢气,使氢气发生器发生爆炸。
氢气的爆炸极限
当空气中混入氧气的体积达到总体积的4%一74.2%,点燃时就会发生爆炸,在这个范围以外,就不会爆炸,因此这个范围被称为氢气的爆炸极限。所以,在点燃氢气前,一定要检验氢气的纯度。
验纯就是化学中检验所的产物的纯度,验纯一般是确保化学实验的安全。
例如,点燃氢气前要验纯,氢气是一种可燃性气体,它的爆炸极限是在与氧气混合4%到74.2%时,如果不验纯,就不知道集气瓶内有没有掺杂的氧气,就容易爆炸。
检验氢气纯度的方法:
实验用品:
酒精灯,铁架台,大试管,干燥的小试管,长颈漏斗,锌粒,稀硫酸。
实验步骤:
1. 用稀硫酸和锌粒制取氢气,用向下排空气法收集氢气。
2. 用大拇指捂住小试管。
3. 点燃洒精灯,试管移近火焰,试管口对着燃着的洒精灯火焰,移开拇指点火。
4. 如听到尖锐的爆鸣声,说明氢气不纯。
5. 如爆鸣声轻而沉闷,说明试管内收集的氢气纯净。
说明:
如果第一次检验的氢气不纯,需再次检纯时,必须用拇指捂住试管口一段时间,使试管内没有燃尽的氢气火焰完全熄灭,方可再次收集氢气,否则易发生仪器爆炸事故。
注意:
必须听到轻微的 “噗”声,才能说明氢气纯度比较高。刚开始收集的气体,大多是发生器里的空气,检验时不会发出声响。把这样的气体当成纯净的氢气使用,点燃时可能会发生爆炸。如果用向下排空气法收集氢气,经检验不纯而需要再检验时,收集前,必须用拇折堵住试管口一会儿,使试管内尚未熄灭的氢气火焰因缺氧而熄火,然后再收集气体检验纯度,否则,试管中没有熄灭的氢气火焰就会点燃氢气发生器里尚混有空气的氢气,使氢气发生器发生爆炸。
氢气的爆炸极限
当空气中混入氧气的体积达到总体积的4%一74.2%,点燃时就会发生爆炸,在这个范围以外,就不会爆炸,因此这个范围被称为氢气的爆炸极限。所以,在点燃氢气前,一定要检验氢气的纯度。
氢气的用途:
| 氢气的性质 | 氢气的用途 |
| 密度最小的气体 | 填充气球 |
| 燃烧放出大量的热 | 做高能燃料;作为新能源 |
| 还原性 | 冶炼金属;做保护气;制高纯硅 |
| 和多种物质反应 | 做化工原料,如制HCl,NH3等 |
催化剂及催化作用的概念:
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
| 概念 | |
| 催化剂 | 在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质。 |
| 催化作用 | 催化剂在化学反应中所起的作用 |
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
概念:
用元素符号和数字的组合表示物质组成的式子,叫做化学式。如可用O2,H2O,MgO分别表示氧气、水、氧化镁的化学式。
对概念的理解:
(1)混合物不能用化学式表示,只有纯净物才能用化学式表示。
(2)每一种纯净物只有一个化学式,但一个化学式有可能用来表示不同的物质。如氧气的化学式是O2,没有别的式子再能表示氧气;P既是红磷的化学式,也是白磷的化学式。
(3)纯净物的化学式不能臆造,化学式可通过以下途径确定:
①科学家通过进行精确的定量实验,测定纯净物中各元素的质量比,再经计算得出。
②已经确定存在的物质可根据化合价写出。
书写规则:
1.单质化学式的写法:
首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2.化合物化学式的写法:
首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
化学式的读法:
一般是从右向左叫做“某化某”,如“CuO”叫氧化铜。当一个分子中原子个数不止一个时,还要指出一个分子里元素的原子个数,如“P2O5”叫五氧化二磷。有带酸的原子团要读成“某酸某”如“CuSO4”叫硫酸铜,还有的要读“氢氧化某”,如“NaOH”叫氢氧化钠。“氢氧化某”是碱类物质,电离出来的负电荷只有氢氧根离子。
化学式的意义:
(1)由分子构成的物质
(2)由原子构成的物质(以Cu为例)
宏观:
表示该物质:铜
表示该物质由什么元素组成:铜由铜元素组成
微观:表示该物质的一个原子—一个铜原子。
②交叉法
确定化学式的几种方法:
1. 根据化合价规则确定化学式
例1:若A元素的化合价为+m,B元素的化合价为-n,已知m与n都为质数,求A,B两元素化合后的物质的化学式。
解析:由题意知正、负化合价的最小公倍数为m ·n,A的原子个数为(m·n)/m=n,B的原子个数为 (m·n)/n=m
答案:所求化学式为AnBm.
2. 根据质量守恒定律确定化学式
例2:根据反应方程式2XY+Y2==2Z,确定Z 的化学式
解析:根据质量守恒定律,反应前后原子种类不变,原子数目没有增减,反应前有两个X原子,四个Y原子,则两个Z分子含有两个X原子和四个Y原子。
答案:z的化学式为XY2
3. 利用原子结构特征确定化学式
例3:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,求X、Y两元素所形成的化合物的化学式。
解析:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,X原子易得1个电子,Y原子易失2个电子,根据电子得失相等可求化合物的化学式为YX2
4.利用元素质量比确定化学式:
例4:有一氮的氧化物,氮、氧两元素的质量比为7: 4,求此氧化物的化学式。
解析:设此氧化物的化学式为NxOy,根据xN:yO =7:4 得14x:16y=7:4,即x:y=2:1。
答案:所求氧化物的化学式为N2O。
5. 利用化学式中所含原子数、电子数确定化学式
例5:某氮氧化合物分子中含有3个原子,23个电子,求此化合物的化学式。
解析:设此化合物的化学式为NxOy,则
x+y=3
7x+8y=23
解得x=1,y=2
答案:所求化学式NO2。
利用化学式的变形比较元素的原子个数:
例:质量相等的SO2和SO3分子中,所含氧原子的个数比为?
解析:SO2的相对分子质量为64,SO3的相对分子质量为80,二者的最小公倍数是320,二者相对分子质量相等时物质的质量相同,转化为分子个数SO2 为320/64=5,SO3为320/80=4,即5SO2与4SO3质量相同,所以含氧原子的个数比为(5×2):(4×3)=10:12=5:6。
四、利用守恒法进行化学式计算:
例:由Na2S、Na2SO3、Na2SO4三种物质构成的混合物中,硫元素的质量分数为32%,则混合物中氧元素的质量分数为?
解析:在Na2S,Na2SO3,Na2SO4中,钠原子与硫原子的个数比是恒定的,都是2:1,因而混合物中钠、硫元素的质量比(或质量分数比)也是恒定的。设混合物中钠元素的质量分数为x,可建立如下关系式。
Na ——S
46 32
x 32%
46/32=x/32%
解得x=46%
混合物中氧元素的质量分数为1-32%-46%=22%。
利用平均值法判断混合物的组成
找出混合物中各组分的平均值(包括平均相对原子质量、平均相对分子质量、平均质量、平均质量分数等),再根据数学上的平均值原理,此平均值总是介于组成中对应值的最大值与最小值之间,由此对混合物的组分进行推理判断。
例:某气休可能由初中化学中常见的一种或多种气体组成,经测定其中只含C,O两种元素,其质量比为3:8,则该气体可能是?
解析:由题给条件知,该气体只含C,O两种元素,而这两种元素组成的气体可能是CO2、CO,O2。CO2中C,O两种元素的质量比是3:8,CO中C,O两种元素的质量比是3:4,O2中C,O两种元素的质量比是0 (因C的质量为0)。题中给出该气体中C,O两种元素的质量比是3:8,故符合题意的气体组成为:CO2或 CO,O2或CO,O2,CO2。
利用关系式法解题技巧:
关系式法是根据化学式所包含的各种比例关系,找出已知量之间的比例关系,直接列比例式进行计算的方法。
例: 多少克(NH4)2SO4与42.4g尿素CO(NH2)2所含的氮元素质量相等?
设与42.4g尿素中所含氮元素质量相等的(NH4)2SO4的质量为x
(NH4)2SO4——2N——CO(NH2)2
132 60
x 42.4g
132/x=60/42.4g
x=93.28
化学式前和化学式中数字的含义:
①化学式前面的数字表示粒子(原子、分子)数目;
②离子符号前的数字表示离子的数目;
③化学式石一下角的数字表示该粒子中对应原子或原子团的数目;
④离子符号右上角的数字表示该离子所带电荷数。

用元素符号和数字的组合表示物质组成的式子,叫做化学式。如可用O2,H2O,MgO分别表示氧气、水、氧化镁的化学式。
对概念的理解:
(1)混合物不能用化学式表示,只有纯净物才能用化学式表示。
(2)每一种纯净物只有一个化学式,但一个化学式有可能用来表示不同的物质。如氧气的化学式是O2,没有别的式子再能表示氧气;P既是红磷的化学式,也是白磷的化学式。
(3)纯净物的化学式不能臆造,化学式可通过以下途径确定:
①科学家通过进行精确的定量实验,测定纯净物中各元素的质量比,再经计算得出。
②已经确定存在的物质可根据化合价写出。
书写规则:
1.单质化学式的写法:
首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2.化合物化学式的写法:
首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
化学式的读法:
一般是从右向左叫做“某化某”,如“CuO”叫氧化铜。当一个分子中原子个数不止一个时,还要指出一个分子里元素的原子个数,如“P2O5”叫五氧化二磷。有带酸的原子团要读成“某酸某”如“CuSO4”叫硫酸铜,还有的要读“氢氧化某”,如“NaOH”叫氢氧化钠。“氢氧化某”是碱类物质,电离出来的负电荷只有氢氧根离子。
化学式的意义:
(1)由分子构成的物质
| 化学式的含义 | 以H2O为例 | ||
| 质的含义 | 宏观 | ①表示一种物质 ②表示物质的元素组成 |
①表示水 ②表示水是由氢、氧两种元素组成的 |
| 微观 | ①表示物质的一个分子 ②表示组成物质每个分子的原子种类和数目 ③表示物质的一个分子中的原子总数 |
①表示一个水分子 ②表示一个水分子是由两个氧原子和一个氧原子构成的 ③表示一个水分子中含有三个原子 | |
| 量的含义 | ①表示物质的相对分子质量 ②表示组成物质的各元素的质量比 ③表示物质中各元素的质量分数 |
①H2O的相对分子质R =18 ②H2O中氢元素和氧元素质量比为1:8 ③H2O中氢元素的质量分数= 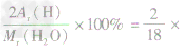 100%=11.1% 100%=11.1% | |
(2)由原子构成的物质(以Cu为例)
宏观:
表示该物质:铜
表示该物质由什么元素组成:铜由铜元素组成
微观:表示该物质的一个原子—一个铜原子。
化学式和化合价的关系:
(1)根据化学式求化合价
①已知物质的化学式,根据化合价中各元素的正负化合价代数和为0的原则确定元素的化合价。
标出已知、未知化合价: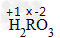
列出式子求解:(+1)×2+x×1+(-2)×3=0 x=+4
②根据化合价原则,判断化学式的正误,如判断化学式KCO3是否正确
标出元素或原子团的化合价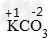
计算正负化合价代数和是否为0:(+1)×1+(-2)×1=-1≠0,所以给出的化学式是错误的,正确的为K2CO3。
③根据化合价原则,计算原子团中某元素的化合价,如计算NH4+中氮元素的化合价和H2PO4-(磷酸二氢根)中磷元素的化合价。
由于NH4+带一个单位的正电荷,不是电中性的,因此各元素的化合价代数和不为多,而是等于+1. 设氮元素的化合价为x
x+(+1)×4=+1 x=-3
所以在NH4+中,氮元素的化合价为-3. 同理H2PO4-带一个单位的负电荷、不是电中性的、因此各元素的化合价代数和不为零,而是-1.
设磷元素的化合价为y
(+1)×2+y+(-2)×4=-1 y=+5 所以在H2PO4-中磷元素的化合价为+5.
④根据化合价原则,确定物质按化合价的排序。如H2S,S,SO2,H2SO4四种物质中均含有硫元素,并且硫元素的化合价在四种物质中分别为:-2,0, +4,+6,故这四种物质是按硫元素的化合价由低到高的顺序排列的。
(2)根据化合价写化学式
根据化合物中化合价的代数和等于0的原则,已知元素的化合价可以推求实际存在物质的化学式,主要方法有两种:
①最小公倍数法
| 步骤 | 举例 | |
| 写 | 一般把正价元素的符号(或原子团)写在左边,负价元素的符号(或原子团)写在右边,并把化合价写在元素符号(或原子团)的正上方 | 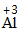 、 、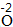 |
| 求 | 求出两种元素化合价绝对位的最小公倍数,然后求出每种元素的原子个数= |
因为|-2|×|+3|=6,所以Al原子个数为6/3=2,O原子个数=6/2=3 |
| 标 | 将原子个数写在相应元素符号的正下角 | Al2O3 |
| 验 | 检验各种元素正负化合价的代数和是否为0,确定化学式的正确性 | (+3)×2+(-2)×3=0,所以该化学式正确。 |
| 步骤 | 例1 硫酸铜 | 例2 氧化钙 | |
| 排列 | 分析名称,确定元素符号(或原子团)的顺序 | 铝 硫酸根 Al SO4 |
钙 氧 Ca O |
| 标价 | 标上化合价 | 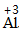 、 、 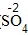 |
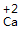 、 、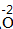 |
| 约简 | 将化合价的绝对值约成最简整数比 |  、 、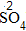 |
 、 、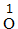 |
| 交叉 | 将整数交叉写在元素符号(或原子团)的右下角 |  |
 |
| 检验 | 根据正负化合价代数和是否为0,检验正误 | (+3)×2+(-2)×3=0 | (+2)+(-2)=0 |
确定化学式的几种方法:
1. 根据化合价规则确定化学式
例1:若A元素的化合价为+m,B元素的化合价为-n,已知m与n都为质数,求A,B两元素化合后的物质的化学式。
解析:由题意知正、负化合价的最小公倍数为m ·n,A的原子个数为(m·n)/m=n,B的原子个数为 (m·n)/n=m
答案:所求化学式为AnBm.
2. 根据质量守恒定律确定化学式
例2:根据反应方程式2XY+Y2==2Z,确定Z 的化学式
解析:根据质量守恒定律,反应前后原子种类不变,原子数目没有增减,反应前有两个X原子,四个Y原子,则两个Z分子含有两个X原子和四个Y原子。
答案:z的化学式为XY2
3. 利用原子结构特征确定化学式
例3:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,求X、Y两元素所形成的化合物的化学式。
解析:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,X原子易得1个电子,Y原子易失2个电子,根据电子得失相等可求化合物的化学式为YX2
4.利用元素质量比确定化学式:
例4:有一氮的氧化物,氮、氧两元素的质量比为7: 4,求此氧化物的化学式。
解析:设此氧化物的化学式为NxOy,根据xN:yO =7:4 得14x:16y=7:4,即x:y=2:1。
答案:所求氧化物的化学式为N2O。
5. 利用化学式中所含原子数、电子数确定化学式
例5:某氮氧化合物分子中含有3个原子,23个电子,求此化合物的化学式。
解析:设此化合物的化学式为NxOy,则
x+y=3
7x+8y=23
解得x=1,y=2
答案:所求化学式NO2。
利用化学式的变形比较元素的原子个数:
例:质量相等的SO2和SO3分子中,所含氧原子的个数比为?
解析:SO2的相对分子质量为64,SO3的相对分子质量为80,二者的最小公倍数是320,二者相对分子质量相等时物质的质量相同,转化为分子个数SO2 为320/64=5,SO3为320/80=4,即5SO2与4SO3质量相同,所以含氧原子的个数比为(5×2):(4×3)=10:12=5:6。
四、利用守恒法进行化学式计算:
例:由Na2S、Na2SO3、Na2SO4三种物质构成的混合物中,硫元素的质量分数为32%,则混合物中氧元素的质量分数为?
解析:在Na2S,Na2SO3,Na2SO4中,钠原子与硫原子的个数比是恒定的,都是2:1,因而混合物中钠、硫元素的质量比(或质量分数比)也是恒定的。设混合物中钠元素的质量分数为x,可建立如下关系式。
Na ——S
46 32
x 32%
46/32=x/32%
解得x=46%
混合物中氧元素的质量分数为1-32%-46%=22%。
利用平均值法判断混合物的组成
找出混合物中各组分的平均值(包括平均相对原子质量、平均相对分子质量、平均质量、平均质量分数等),再根据数学上的平均值原理,此平均值总是介于组成中对应值的最大值与最小值之间,由此对混合物的组分进行推理判断。
例:某气休可能由初中化学中常见的一种或多种气体组成,经测定其中只含C,O两种元素,其质量比为3:8,则该气体可能是?
解析:由题给条件知,该气体只含C,O两种元素,而这两种元素组成的气体可能是CO2、CO,O2。CO2中C,O两种元素的质量比是3:8,CO中C,O两种元素的质量比是3:4,O2中C,O两种元素的质量比是0 (因C的质量为0)。题中给出该气体中C,O两种元素的质量比是3:8,故符合题意的气体组成为:CO2或 CO,O2或CO,O2,CO2。
利用关系式法解题技巧:
关系式法是根据化学式所包含的各种比例关系,找出已知量之间的比例关系,直接列比例式进行计算的方法。
例: 多少克(NH4)2SO4与42.4g尿素CO(NH2)2所含的氮元素质量相等?
设与42.4g尿素中所含氮元素质量相等的(NH4)2SO4的质量为x
(NH4)2SO4——2N——CO(NH2)2
132 60
x 42.4g
132/x=60/42.4g
x=93.28
化学式前和化学式中数字的含义:
①化学式前面的数字表示粒子(原子、分子)数目;
②离子符号前的数字表示离子的数目;
③化学式石一下角的数字表示该粒子中对应原子或原子团的数目;
④离子符号右上角的数字表示该离子所带电荷数。

发现相似题
与“氢气是未来的理想能源,科学家正在探究光分解水制取氢气反应...”考查相似的试题有:
- 关于催化剂在化学反应前后的变化,下列说法正确的是:①质量减小;②质量不变;③化学性质改变;④化学性质不变;⑤二氧化锰可作各...
- 相同数目的二氧化硫SO2和二氧化碳CO2的分子中,含有相同的( )A.氧分子个数B.氧原子个数C.氧元素的个数D.氧元素的质量分数
- 西北工业大学张立同院士获得了2004年国家技术发明一等奖,她与她的同事研制的碳化硅陶瓷基复合材料是一种新型热结构材料.它...
- 室内污染的主要成分之一甲醛(化学式为CH2O),它来源于室内装潢所用的油漆胶合板等材料.下列关于甲醛的说法正确的是 ( )A...
- 如图是某同学进行反思性学习的总结和归纳,A、B、C三种物质都含有同一种元素,这种元素的化合价逐渐升高.结合归纳图回答:(...
- 氢氧化铜的化学式是______,它属于______类(填“酸”“碱”“盐”,下同).Na2CO3的俗名叫______,它属于______类.
- 下列物质的化学式与名称一致的是( )A.氧化镁 MgO2B.二氧化硫 O2SC.氯气 Cl2D.锰酸钾 KMnO4
- 以下内容请你用最合适的化学式或微粒符号填空:(1)含氧元素质量分数最高的氧化物 ______;(2)硫酸钠中的阴离子 ______;...
- SO2的正确读法是( )A.二氧化一硫B.二氧化硫C.氧化硫D.一氧化二硫
- 地壳中含量最多的金属元素是______元素,其元素符号为______,它与地壳中含量最多的非金属元素形成的化合物的化学式为______.