本试题 “化学思想的建立对于化学学习起着至关重要的作用,“物质的性质常决定物质的用途”是常用的一种化学思想,下列关于这一思想,说法错误的是( )A.氧气可以支持...” 主要考查您对氧气的用途
金属的化学性质
二氧化碳的用途
碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧气的用途
- 金属的化学性质
- 二氧化碳的用途
- 碳的性质
用途作用:
1. 冶炼工艺 在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,这不但降低了钢的含碳量,还有利于清除磷、硫、硅等杂质。而且氧化过程中产生的热量足以维持炼钢过程所需的温度,因此,吹氧不但缩短了冶炼时间,同时提高了钢的质量。高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。在有色金属冶炼中,采用富氧也可以缩短冶炼时间提高产量。
2. 化学工业
在生产合成氨时,氧气主要用于原料气的氧化,以强化工艺过程,提高化肥产量。再例如,重油的高温裂化,以及煤粉的气化等。
3. 国防工业
液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧炸药。
4. 医疗保健
供给呼吸:用于缺氧、低氧或无氧环境,例如:潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
5. 其它方面
如:它本身作为助燃剂与乙炔、丙烷等可燃气体配合使用,达到焊割金属的作用,各行各业中,特别是机械企业里用途很广,作为切割之用也很方便,是首选的一种切割方法。
过度吸氧负作用:
早在19世纪中叶,英国科学家保尔·伯特首先发现,如果让动物呼吸纯氧会引起中毒,人类也同样。氧气瓶氧气瓶人如果在大于0.05MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各脏器缺氧而发生损害。在0.1MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。人在0.2MPa(2个大气压)高压纯氧环境中,最多可停留1.5小时~2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。如加入0.3MPa(3个大气压)甚至更高的氧,人会在数分钟内发生脑细胞变性坏死,抽搐昏迷,导致死亡。
此外,过量吸氧还会促进生命衰老。进入人体的氧与细胞中的氧化酶发生反应,可生成过氧化氢,进而变成脂褐素。这种脂褐素是加速细胞衰老的有害物质,它堆积在心肌,使心肌细胞老化,心功能减退;堆积在血管壁上,造成血管老化和硬化;堆积在肝脏,削弱肝功能;堆积在大脑,引起智力下降,记忆力衰退,人变得痴呆;堆积在皮肤上,形成老年斑。
缺氧和富氧对人体的影响:
氧气浓度(%体积)---征兆(大气压力下)
100%---致命/6分钟;
50%---致命/4-5分钟经治疗可痊愈
>23.5%---富氧,有强烈爆炸危险
20.9%---氧气浓度正常
19.5%---氧气最小允许浓度
15-19%---降低工作效率,并可导致头部、肺部和循环系统问题
10-12%---呼吸急促,判断力丧失,嘴唇发紫
8-10%---智力丧失,昏厥,无意识,脸色苍白,嘴唇发紫,恶心呕吐
6-8%---8分钟;
4-6%---40秒内抽搐,呼吸停止,死亡
金属的化学性质:
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
2.金属与酸的反应
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 |
点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 | 2Cu+O2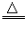 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | —— | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
二氧化碳用途:
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
概述:
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2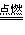 CO2
CO2
氧气不充分的条件下:2C+O2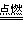 2CO
2CO
3.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2 CO2
CO2
氧气量不充足时,碳不充分燃烧:2C+O2 2CO
2CO
mg碳与ng氧气反应:
①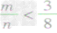 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;
②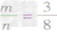 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2;
③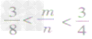 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;
④ 时,恰好完全反应生成CO;
时,恰好完全反应生成CO;
⑤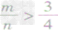 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。
碳单质及其化合物间的转化:
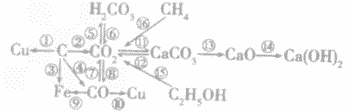
(1)C+2CuO 2Cu+CO2↑
2Cu+CO2↑
(2)C+O2 CO2
CO2
(3)3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
(4)2C+O2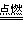 2CO
2CO
(5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2 2CO2
2CO2
(8)C+CO2 2CO
2CO
(9)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(10)CO+ 2CuO 2Cu + CO2
2Cu + CO2
(11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3 CaO+CO2
CaO+CO2
(14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
(16)CH4+O2 CO2+2H2O
CO2+2H2O
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2
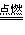 CO2
CO2 氧气不充分的条件下:2C+O2
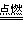 2CO
2CO 3.还原性:
木炭还原氧化铜:C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O4
 3Fe+2CO2↑
3Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2
 CO
CO 碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2
 CO2
CO2 氧气量不充足时,碳不充分燃烧:2C+O2
 2CO
2CO mg碳与ng氧气反应:
①
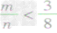 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;②
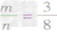 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2; ③
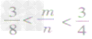 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;④
 时,恰好完全反应生成CO;
时,恰好完全反应生成CO; ⑤
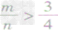 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。 碳单质及其化合物间的转化:

(1)C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ (2)C+O2
 CO2
CO2(3)3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ (4)2C+O2
 2CO
2CO (5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2
 2CO2
2CO2 (8)C+CO2
 2CO
2CO(9)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 (10)CO+ 2CuO
 2Cu + CO2
2Cu + CO2 (11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3
 CaO+CO2
CaO+CO2 (14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O(16)CH4+O2
 CO2+2H2O
CO2+2H2O 发现相似题
与“化学思想的建立对于化学学习起着至关重要的作用,“物质的性质...”考查相似的试题有:
- 下列关于氧气的说法中,不正确的是( )A.氧气能使带火星的木条燃烧B.氧气能供给呼吸、支持燃烧,因此它对人类是有百利而无...
- 用下图装置做硫燃烧的实验。(1)硫在空气中燃烧不如在氧气中剧烈的原因是 。(2)观察到实验现象后,为尽量减少二氧化硫逸散...
- 化学来自生活,用于生活.下表列出了生活中常用物质溶液的pH及一种主要成分(其他成分未列出);编号①②③④⑤名称食醋白酒白糖水...
- 物质的性质决定用途.下列物质的用途和性质不一致的是( )A.铜导电性好作导线B.铝密度小作飞机材料C.金延展性好做成金箔D...
- 下列说法正确的是( )A.铝和铜的传热、导电性都很好B.把生铁炼成钢就是把生铁中的杂质全部除去,使其中变为纯铁C.在地壳...
- 目前,市场上某些不法分子利用黄铜(金黄色的铜、锌合金)制成假黄金首饰,欺骗消费者.下列说法中不能区别真伪的是( )A....
- (5分)金属及金属材料在日常生活中应用广泛。(1)铝可以制成铝箔,这是利用金属的 。(2)生铁和钢都是铁合金,它们主要是...
- 用下列装置进行证明质量守恒定律的实验,将反应物混合后,反应前后容器中物质的总质量不相等的是( )A.B.C.D.
- 下列说法中,错误的是[ ]A.一种元素都只能组成一种单质B.在温室里施用CO2作肥料,可提高农作物产量C.CO、SO2、NO2都是污染...
- 请用:①稳定性 ②可燃性 ③导电性 ④还原性,填写下列空格(填序号)。(1)石墨可作电池的电极,说明石墨具有_________;(2)“...