本试题 “化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.Ⅰ、氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢...” 主要考查您对化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡的有关计算
化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
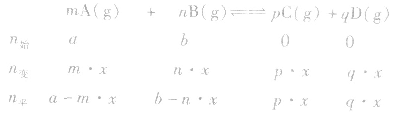
则有:

(2)对于反应物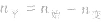 ,对于生成物
,对于生成物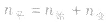
(3)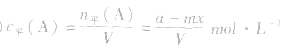
(4)A的转化率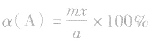
(5)平衡时A的体积(物质的量)分数
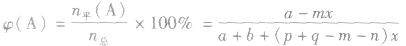
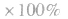
(6)
(7)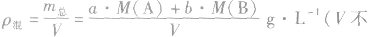
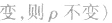
(8)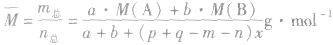
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
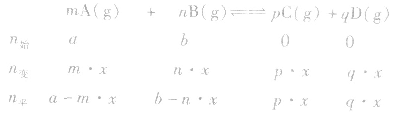
则有:

(2)对于反应物
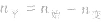 ,对于生成物
,对于生成物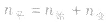
(3)
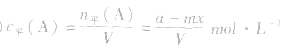
(4)A的转化率
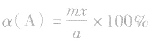
(5)平衡时A的体积(物质的量)分数
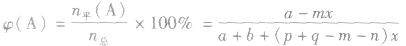
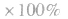
(6)

(7)
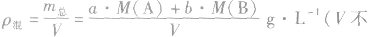
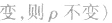
(8)
发现相似题
与“化学在能源开发与利用中起到十分关键的作用.氢气是一种新型...”考查相似的试题有:
- (6分)PCl5的热分解反应如下:PCl5(g) PCl3(g) + Cl2(g)。(1)写出反应的平衡常数表达式;(2)已知某温度下,在容积为10.0...
- 在一定温度和压强下,有如下反应:2SO2(g)+O2(g)2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的...
- 可逆反应A(?)+aB(g) C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如...
- 在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g)C(g)+D(g)已达到平衡状态的现象是A.混合气体的...
- 下列说法可以证明反应N2+3H22NH3已达到平衡状态的是( )A.1molN≡N键断裂的同时,有3molH—H键生成B.1molN≡N键断裂的同时,有3...
- 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。汽车尾气中CO与H2O(g)在一...
- 在容积恒定的密闭容器中,存在下列平衡:2HBr(g)H2(g)+Br2(g)-Q,若升高温度,发生改变的是 ( )A.分子数B.压强C...
- 体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生下列反应:2SO2(g)+O2(g)2SO3(g),并达到平衡...
- 在同温同压有催化剂存在下,向一固定容积的容器中充入N2、H2,发生N2+3H22NH3反应,反应达到平衡时,在下列比例中生成NH3的量...
- 在平衡体系2NO+O2 2NO2中通入18O组成的氧气,重新达到平衡后,则18OA.只存在于O2中B.只存在于NO2中C.只存在于O2和NO2中D....