本试题 “下列有关说法,错误的是[ ]A.氮氧化物、二氧化硫都是形成酸雨的主要物质B.工业合成氨及用NH3制化肥(NH4)2SO4都属于氮的固定C.一定条件下,镁能与一些非金...” 主要考查您对镁的单质及其化合物
二氧化硅
硅酸盐
二氧化硫
一氧化氮
二氧化氮
合成氨(人工固氮)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 镁的单质及其化合物
- 二氧化硅
- 硅酸盐
- 二氧化硫
- 一氧化氮
- 二氧化氮
- 合成氨(人工固氮)
镁:
化学式Mg,它是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。镁元素在自然界广泛分布,是人体的必需元素之一,原子结构示意图: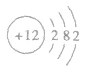 。
。
氧化镁:
化学式MgO是镁的氧化物,一种离子化合物。常温下为一种白色固体。氧化镁以方镁石形式存在于自然界中,是冶镁的原料。
氢氧化镁:
化学式Mg(OH)2,式量58.32。白色无定形粉末。难溶于水,易溶于稀酸和铵盐溶液。饱和水溶液的浓度为1.9毫克/升(18℃),呈碱性。加热到350℃失去水生成氧化镁。用做分析试剂,还用于制药工业。氧化镁跟水反应可得氢氧化镁。
镁及其化合物的物理性质和化学性质:
| 物理性质 | 化学性质 | |
| Mg | 银白色固体,密度1.738g﹒cm3-,熔点645℃,沸点1090℃,导电导热性较好,延展性较好 | ①镁和铝两元素的原子最外层分别有2个和3个电子。在参加化学反应时,容易失去最外层电子成为阳离子,表现还原性。 Mg-2e-==Mg2+ ②镁与非金属反应 O2+2Mg  2MgO 2MgOCl2+Mg  MgCl2 MgCl2 S+Mg  MgS MgS3Mg+N2  Mg3N2 Mg3N2 说明在常温下,镁能与空气里的氧气发生反应,生成一层致密的氧化物薄膜,从而使金属失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有抗腐蚀性。 ③镁与酸反应 2HCl+Mg==MgCl2+H2↑ 2H++Mg==Mg2++H2↑ 镁跟硝酸、浓硫酸反应时,硝酸中的氮元素、硫酸中的硫元素被还原,不生成氢气。 ④镁跟某些氧化物反应 2Mg+CO2  C+2MgO C+2MgO ⑤镁跟水反应 Mg+2H2O  Mg(OH)2+H2↑ Mg(OH)2+H2↑ 说明:镁跟冷水反应非常缓慢. |
| MgO | 白色固体,离子化合物,熔点为3073K,硬度(莫氏)为6.5,难溶于水的固体,熔点很高,是很好的耐火材料 | 典型的碱性氧化物,不能与水反应 |
| Mg(OH)2 | 白色难溶于水的固体,其水溶液中c(OH-)很小,可以使酚酞溶液变成浅红色 Mg(OH)2(s)  Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
①可与酸反应生成盐和水,如Mg(OH)2+2HCl==MgCl2+2H2O ②热稳定性差,受热容易分解 Mg(OH)2  MgO+H2O MgO+H2O |
工业制备镁:
电解熔融状态的氯化镁制取镁
阳极反应:2Cl--2e-==Cl2↑
阴极反应:Mg2++2e-==Mg
总反应:MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
Mg2++2Cl-==Mg+Cl2↑
说明氧化镁比氯化镁熔点高,为了降低能耗,工业电解制取镁采用的原料是氯化镁而不是氧化镁。
氧化镁的应用:
氧化镁可用于染料,油漆,玻璃,化学试剂,医药,食品添加剂等方面,工业上利用MgO熔点高的特点,制造耐火材料。
二氧化硅:
①化学式SiO2
②相对分子质量:60
③类别:酸性氧化物
④晶体类型:原子晶体
⑥晶体中粒子间的作用力:共价键
二氧化硅的物理性质和化学性质:
(1)物理性质:无色透明或白色粉末,原子晶体,熔沸点都很高,坚硬难熔,不溶于水,天然的二氧化硅俗称硅石,是构成岩石的成分之一。
(2)化学性质:不活泼
①不与水反应,不能跟酸(氢氟酸除外)发生反应。
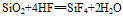 (氢氟酸不能盛放在玻璃容器中)。
(氢氟酸不能盛放在玻璃容器中)。②具有酸性氧化物的性质,能跟碱性氧化物或强碱反应。
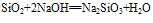 (实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
(实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
 (制玻璃)
(制玻璃)③具有弱氧化性


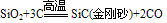
知识点拨:
二氧化硅晶体的结构若在硅晶体结构中的每个Si—Si键中“插入”一个氧原子,便可得到以硅氧四面体 (SiO4)为骨架的二氧化硅的结构,如图所示。在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,即每个硅原子与四个氧原子形成四个共价键,每个氧原子与两个硅原子形成共价键,因此,二氧化硅晶体中硅原子和氧原子的个数比为1:2,二氧化硅的化学式为SiO2.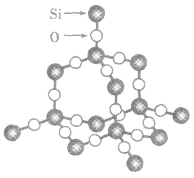
二氧化硅的用途:
①光导纤维的主要原料
②石英的主要成分是SiO2,纯净的石英可用来制造石英玻璃。石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。 水晶常用来制造电子工业中的重要部件、光学仪器,也用来制造高级工艺品和眼镜片。
③玛瑙石含有有色杂质的石英晶体,可用于制造精密仪器轴承,耐磨器皿和装饰品。
①硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用二氧化硅和金属氧化物的形式表示。例如:硅酸钠Na2SiO3(Na2O·SiO2);镁橄榄石Mg2SiO4(2MgO·SiO2);高岭石Al2(Si2O5)(OH)4(Al2O3·2SiO2·2H2O)
②云母、滑石、石棉、高岭石等,它们都属于天然的硅酸盐。
③人造硅酸盐:主要有玻璃、水泥、各种陶瓷、砖瓦、耐火砖、水玻璃以及某些分子筛等。
④硅酸盐制品性质稳定,熔点较高,难溶于水,有很广泛的用途。最简单硅酸盐是硅酸钠,其水溶液俗称水玻璃,是一种矿物胶,可作粘合剂,防腐剂。
硅酸钠:
(1)化学式:Na2SiO3
(2)俗称:其水溶液俗称水玻璃
(3)物理性质:硅酸钠溶液是无色黏稠液体
(4)化学性质:
①与盐酸反应 Na2SiO3+2HCl==== 2NaCl+H2SiO3(胶体)
②与CO2反应 NaSiO3+CO2+H2O ==Na2CO3+H2SiO3↓
③与水发生水解反应硅酸钠溶液显碱性
(5)制备:SiO2+2NaOH== Na2SiO3+H2O
(6)保存:试剂瓶不能配磨口玻璃塞
(7)用途:常用于制备硅胶和木材防火剂等
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


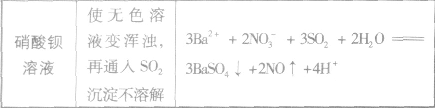
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表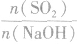 ,如下数轴所示:
,如下数轴所示: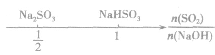
分析数轴可得:
(1)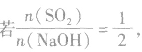 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)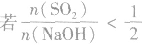 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)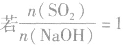 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)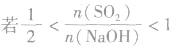 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)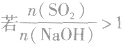 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
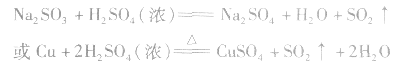
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

氮元素有+1、+2、+3、+4、+5五种正价,五种正价对应六种氧化物N2O(俗称“笑气”,具有麻醉作用)、 NO、N2O4(暗蓝色气体)、NO2、N2O4、N2O5(白色固体)。其中N2O3和N2O5分别是HNO2和HNO3的酸酐,它们都是空气污染物,空气中的NO2是造成光化学污染的主要因素。另外,在思考某些问题时,要注意:2NO2
 N2O4。对气体体积及平均相对分子质量的影响:
N2O4。对气体体积及平均相对分子质量的影响:一氧化氮的物理性质和化学性质:
(1)物理性质:无色、不溶于水、有毒的气体,密度比空气稍重。
(2)化学性质:
①极易被空气中的O2氧化: 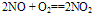
②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性。
二氧化氮的物理性质和化学性质:
(1)物理性质:红棕色、有刺激性气味、有毒的气体,易溶于水、易液化,比空气重。
(2)化学性质:
与H2O反应: 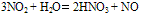
(工业制HNO3原理,在此反应中,NO2同时作氧化剂和还原剂)
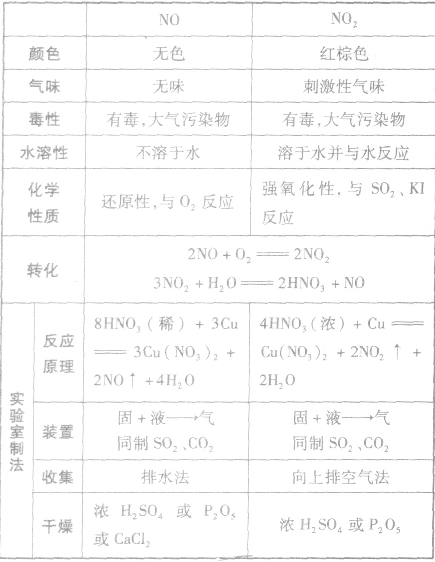
NO、NO2的性质、实验室制法的比较:
隐含反应: 的应用:
的应用:
通常“纯净”的NO2或N2O4并不纯,因为在常温、常压下能发生反应 ,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
1.收集到的1mo1NO2在标准状况下的体积应小于22.4L
2.标准状况下22.4LNO2的质量大于46g。
3.NO与O2混合后,所得物质的相对分子质量应大于按体积比求得的数值。
4.温度影响“ ”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
5.恒容时,在“ ”平衡体系中增加 N01,相当于增大压强。
”平衡体系中增加 N01,相当于增大压强。
有关混合气体NO、NO2、O2溶于水的计算:
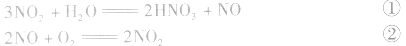
①×2+②得NO2、O2与水反应生成HN3,的化学方程式为: 
①×2+②×3得NO、O2与水反应生成HNO3的化学方程式为: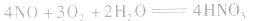
一般NO、NO2、O2与水反应,可归纳成四种情况:
1.NO和NO2混合 剩余气体为NO
剩余气体为NO
2.NO2和O2混合
3.NO和O2混合 
4.NO2、NO、O2的混合
当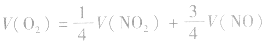 时,反应后无气体剩余
时,反应后无气体剩余
特例:当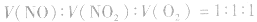 时,无气体剩余。
时,无气体剩余。
1.定义:氮的固定是指将游离态的氮转化为化合态氮的方法。
2.方法:氮的固定主要方法有:
(1)人工合成氨 :化学固氨法。其条件要求高、成本高、转化率低、效率低。
(2)根瘤菌,生物固氨。常温常压下进行。成本低、转化率高、效率高。
3.工业应用:模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并创造崭新的化学工艺过程。 二、合成氨的反应原理
1.加热试管中的铁丝绒至红热后注入氢气和氨气的混合气体,可以看到湿润的PH试纸变蓝色
2.用氢 气和氨气合成氨的反应式是
N2+3H2
 2NH3,属放热反应。
2NH3,属放热反应。 3.工业上,采用以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件下合成氨。
(1)催化剂的主要作用:成千上万倍地加快化学反应速率,缩短达平衡的时间,提高日产量。
(2)合成氨的适宜条件:以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件
(3)选择适宜生产条件的原则:有较高的反应速率和平衡转化率,能最大限度地提高利润。
(4)合成氨生产时,不采用尽可能高的压强,通常采用10MPa~30MPa 的压强,否则会增大设备的动力要求,增大成本。
(5)合成氨的反应为放热反应,降低温度促使平衡向有移动,有利于N2、H2转化为NH3;但降温必然减缓了反应速率,影响单位时间产率。生产中将二者综合考虑,既要保证N2、H2的转化率,又要保证较快的反应速率,只能选择适中的温度400~500℃左右。应注意该温度为催化剂活化温度,低于此温度,催化剂不起作用。
(6)催化剂是影响反应速率的几个因素中,对反应速率影响程度最大的。
催化剂的特点:
①选择性:不 同的反应选择不同的催化剂,如合成氨选择了铁触媒。每种催化剂都是对特定的反应有催化作用,并非能改变任何化学反应的速率。
②灵敏性:催化剂中混入杂质,常常会失去催化作 用,称催化剂“中毒”,因此 反应气体进入反应器前必须净化。 ③催化剂只有在活化温度以上才能起催化作用,如铁触媒活化温度为400~500℃,因此该温度为合成氨的适宜温度。
人工固氮技术——合成氨:
1.生产原理
2.合成氨的基本生产过程
(1)原料气的制备要实现合成氨的工业化生产,首先要解决氢气和氮气的来源问题。
①氮气的制备合成氨所需要的氮气都取自空气。从空气中制取氮气通常有两种方法:一是将空气液化后蒸发分离出氧气而获得氮气;二是将空气中的氧气与碳作用生成二氧化碳,再除去二氧化碳得到氮气。
②氢气的制备氢气主要来源于水和碳氢化合物。氢气的制取有下表中的几条途径。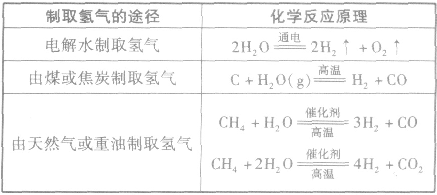
(2)原料气的净化
原料气的净化就是除去原料气中的杂质。在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨所用的催化剂“中毒”(所谓“中毒”即是催化剂失去催化活性),所以必须除去。原料气净化的主要目的是防止催化剂“中毒”。
(3)氨的合成与分离
①氨的合成工业合成氨的主要设备是合成塔。将净化后的原料气经过压缩机压缩后输人合成塔,经过下列化学反应合成氨: 
②氨的分离从合成塔出来的混合气体,通常约含15%(体积分数)的氨。为了使氨从未反应的氮气和氢气里分离出来,要把混合气体通过冷凝器使氨液化,然后在气体分离器里把液态氨分离出来导入液氨贮罐。南气体分离器出来的气体,经过循环压缩机,再送到合成塔中进行反应。
3.合成氨适宜条件的选择
外加条件要尽可能加快反应速率,提高反应物的转化率.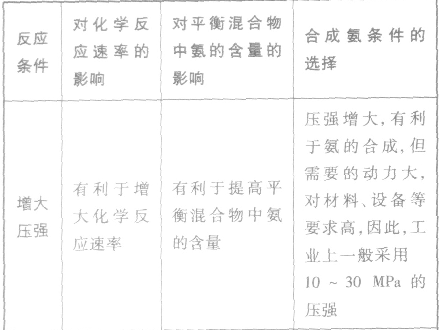
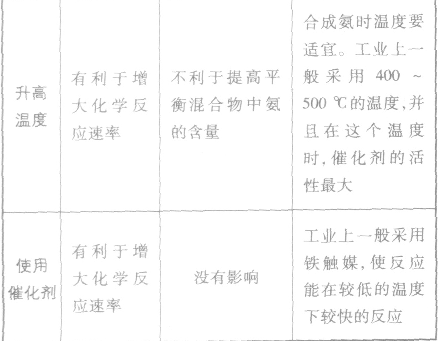
4.合成氨的环境保护
随着环境保护意识的增强,以及相关的法律、法规的严格实施,合成氨生产中可能产生的“三废”的处理越来越成为技术改造的重要问题。
(1)废渣
主要来自造气阶段,特别是以煤为原料而产生的煤渣,用重油为原料产生的炭黑等,现在大都将它们用作建材和肥料的原料。
(2)废气
主要是H2S和CO2等气体。对H2S气体的处理,先后采用了直接氧化法(选择性催化氧化)、循环法(使用溶剂将其吸收浓缩)等回收技术。对CO2 的处理,正在不断研究和改进将其作为尿素和碳铵生产原料的途径。
(3)废液
主要是含氰化物和含氨的污水。目前,处理含氰化物污水主要有生化、加压水解、氧化分解、化学沉淀、反吹回炉等方法;处理含氨废水多以蒸馏的方法回收氨达到综合利用的目的,对浓度过低的含氨废水,可用离子交换法治理。
与“下列有关说法,错误的是[ ]A.氮氧化物、二氧化硫都是形成酸...”考查相似的试题有:
- 下表各物质中,不满足下图物质一步转化关系的是[ ]XYZA.SiO2Na2SiO3H2SiO3B.SO2 SO2H2SO4C.NH3 NONO2D.C COCO2
- 下列物品或设备中,不含二氧化硅的是A.石英光导纤维B.计算机芯片C.门窗玻璃D.玛瑙手镯
- 下列说法中正确的是[ ]A.CaCO3与CaSiO3的热稳定性关系是CaCO3
- 白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示)。(1)取8.l0g白玉粉末灼烧至恒重,固体减少了0...
- 下列有关物质的性质、用途的说法中正确的是[ ]A.金属腐蚀既有氧化还原反应,又有非氧化还原反应B.NaCl是一种化工原料,可以...
- 下列说法正确的是[ ]A.少量SO2通过浓的CaCl2溶液能生成白色沉淀B.可以用澄清石灰水鉴别SO2和CO2C.硫粉在过量的纯氧中燃烧...
- 工业上用含80% FeS2的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O2、盐酸反应):4FeS2+11O22Fe2O3+8SO2 ①FeS2...
- 9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2.24 L,将溶液稀释为1 L,测得溶液的pH=1...
- (7分)工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g—0.5g。已知NaNO2能发生如下反应:aNO...
- 下列关于浓HNO3与浓H2SO4的叙述正确的是A.露置于空气中,溶液浓度均降低B.常温下都能与铜较快反应C.在加热时都容易分解D....