本试题 “下列说法不正确的是[ ]A.中学化学教材中的三大化工生产:氯碱工业、硫酸工业、合成氨工业过程中均涉及氧化还原反应B.人造纤维、合成纤维是有机高分子化合物,...” 主要考查您对金属的焰色反应
光导纤维
塑料、纤维、橡胶
合成氨(人工固氮)
工业制硫酸
氯碱工业
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 金属的焰色反应
- 光导纤维
- 塑料、纤维、橡胶
- 合成氨(人工固氮)
- 工业制硫酸
- 氯碱工业
(1)有些金属或它们的化合物在灼烧时会使火焰呈现出特色的颜色的想象。
(2)操作:
①洗:用盐酸洗去铂丝表面的杂质
②烧:将铂丝在酒精灯火焰上灼烧至于酒精灯颜色一致
③蘸:蘸取试样
④烧:在火焰上灼烧
⑤观:观察火焰颜色(若检验钾要透过钴玻璃观察)
(3)常见的颜色反应
Li Na K Ca Sr Ba Cu
紫红 黄 紫(透过蓝色钴玻璃片) 砖红 洋红 黄绿 绿
①焰色反应为物理变化过程。
②焰色现象与金属元素的存在有关,与物质组成无关。如:钠元素的焰色为黄色,包括钠单质以及钠的所有化合物。
光导纤维:
简称光纤,主要成分为SiO2,是一种能高质量传导光的玻璃纤维。如果将许多根经过技术处理的光纤绕在一起,就得到我们常说的光缆。光纤除了可以用于通讯外,还用于医疗、信息处理、传能传像、遥测遥控、照明等许多方面。例如,可将光导纤维内窥镜导入心脏,测量心脏中的血压、温度等。在能量和信息传输方面,光导纤维也得到了广泛的应用。
光导纤维主要特性:
①传导光的能力非常强
②抗干扰性能好,不发生电辐射,通讯质量高
③质量轻,光缆纤细,耐腐蚀
光导纤维主要用途:
通讯、医疗、信息处理、传能传像、遥测遥控、照明等
合成材料:
又称人造材料,是人为地把不同物质经化学方法或聚合作用加工而成的材料,其特质与原料不同,如塑料、玻璃、钢铁等。三大合成材料:塑料、合成纤维、合成橡胶
塑料:
主要成分合成树脂(高聚物),还含有增塑剂和防老化剂等添加剂,一定属人工合成的。
热塑性塑料:线形结构受热会熔化、冷却会硬化,多次使用,如聚乙烯塑料,聚丙烯塑料等
热固性塑料:受热会交联成立体网状结构,一次使用酚醛树脂,脲醛树脂等
纤维:
天然纤维:属纤维素,棉花、麻等属蛋白质:羊毛和蚕丝等
人造纤维:用木材等为原料加工成的人造棉、人造丝、玻璃纸等仍属纤维素
合成纤维(六大纶) 用石油、天然气、煤核农副产品等为原料人工合成的高分子材料 锦纶(尼龙)、涤纶(的确良)、腈纶(人造羊毛)、维纶、氯纶、丙纶
橡胶:
(1)天然橡胶:聚异戊二烯
(2)合成橡胶:
通用橡胶:丁苯橡胶、氯丁橡胶、顺丁橡胶
特种橡胶:耐热耐酸碱的氟橡胶、耐高温耐严寒的硅橡胶
一般橡胶:线型结构,可塑性好,但强度和韧性差
硫化橡胶:加硫后通过硫桥交联成立体型的网状结构,强度和韧性高、弹性好、化学稳定
1.定义:氮的固定是指将游离态的氮转化为化合态氮的方法。
2.方法:氮的固定主要方法有:
(1)人工合成氨 :化学固氨法。其条件要求高、成本高、转化率低、效率低。
(2)根瘤菌,生物固氨。常温常压下进行。成本低、转化率高、效率高。
3.工业应用:模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并创造崭新的化学工艺过程。 二、合成氨的反应原理
1.加热试管中的铁丝绒至红热后注入氢气和氨气的混合气体,可以看到湿润的PH试纸变蓝色
2.用氢 气和氨气合成氨的反应式是
N2+3H2
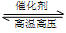 2NH3,属放热反应。
2NH3,属放热反应。 3.工业上,采用以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件下合成氨。
(1)催化剂的主要作用:成千上万倍地加快化学反应速率,缩短达平衡的时间,提高日产量。
(2)合成氨的适宜条件:以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件
(3)选择适宜生产条件的原则:有较高的反应速率和平衡转化率,能最大限度地提高利润。
(4)合成氨生产时,不采用尽可能高的压强,通常采用10MPa~30MPa 的压强,否则会增大设备的动力要求,增大成本。
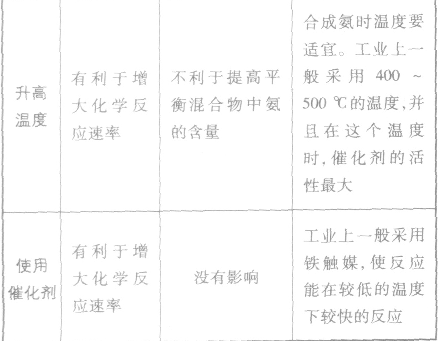
(5)合成氨的反应为放热反应,降低温度促使平衡向有移动,有利于N2、H2转化为NH3;但降温必然减缓了反应速率,影响单位时间产率。生产中将二者综合考虑,既要保证N2、H2的转化率,又要保证较快的反应速率,只能选择适中的温度400~500℃左右。应注意该温度为催化剂活化温度,低于此温度,催化剂不起作用。
(6)催化剂是影响反应速率的几个因素中,对反应速率影响程度最大的。
催化剂的特点:
①选择性:不 同的反应选择不同的催化剂,如合成氨选择了铁触媒。每种催化剂都是对特定的反应有催化作用,并非能改变任何化学反应的速率。
②灵敏性:催化剂中混入杂质,常常会失去催化作 用,称催化剂“中毒”,因此 反应气体进入反应器前必须净化。 ③催化剂只有在活化温度以上才能起催化作用,如铁触媒活化温度为400~500℃,因此该温度为合成氨的适宜温度。
人工固氮技术——合成氨:
1.生产原理
2.合成氨的基本生产过程
(1)原料气的制备要实现合成氨的工业化生产,首先要解决氢气和氮气的来源问题。
①氮气的制备合成氨所需要的氮气都取自空气。从空气中制取氮气通常有两种方法:一是将空气液化后蒸发分离出氧气而获得氮气;二是将空气中的氧气与碳作用生成二氧化碳,再除去二氧化碳得到氮气。
②氢气的制备氢气主要来源于水和碳氢化合物。氢气的制取有下表中的几条途径。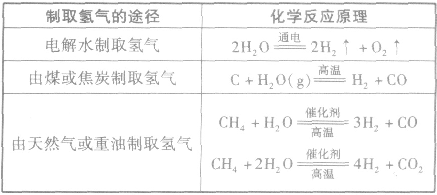
(2)原料气的净化
原料气的净化就是除去原料气中的杂质。在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨所用的催化剂“中毒”(所谓“中毒”即是催化剂失去催化活性),所以必须除去。原料气净化的主要目的是防止催化剂“中毒”。
(3)氨的合成与分离
①氨的合成工业合成氨的主要设备是合成塔。将净化后的原料气经过压缩机压缩后输人合成塔,经过下列化学反应合成氨: 
②氨的分离从合成塔出来的混合气体,通常约含15%(体积分数)的氨。为了使氨从未反应的氮气和氢气里分离出来,要把混合气体通过冷凝器使氨液化,然后在气体分离器里把液态氨分离出来导入液氨贮罐。南气体分离器出来的气体,经过循环压缩机,再送到合成塔中进行反应。
3.合成氨适宜条件的选择
外加条件要尽可能加快反应速率,提高反应物的转化率.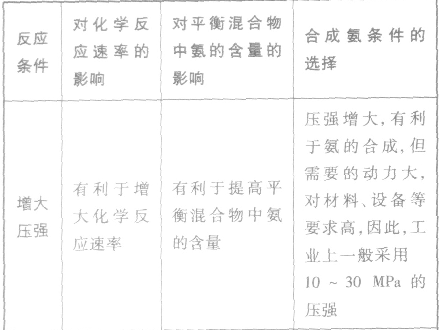
4.合成氨的环境保护
随着环境保护意识的增强,以及相关的法律、法规的严格实施,合成氨生产中可能产生的“三废”的处理越来越成为技术改造的重要问题。
(1)废渣
主要来自造气阶段,特别是以煤为原料而产生的煤渣,用重油为原料产生的炭黑等,现在大都将它们用作建材和肥料的原料。
(2)废气
主要是H2S和CO2等气体。对H2S气体的处理,先后采用了直接氧化法(选择性催化氧化)、循环法(使用溶剂将其吸收浓缩)等回收技术。对CO2 的处理,正在不断研究和改进将其作为尿素和碳铵生产原料的途径。
(3)废液
主要是含氰化物和含氨的污水。目前,处理含氰化物污水主要有生化、加压水解、氧化分解、化学沉淀、反吹回炉等方法;处理含氨废水多以蒸馏的方法回收氨达到综合利用的目的,对浓度过低的含氨废水,可用离子交换法治理。
工业制硫酸的方法:
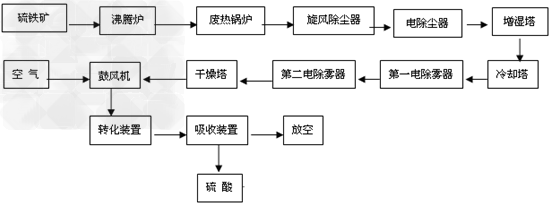
(1)硫铁矿制酸硫铁矿在沸腾焙烧炉内通空气燃烧产生SO2气体,经余热锅炉回收热量后,依次通过旋风除尘和电除尘进行干法除尘。随后,炉气再通过洗涤、冷却、除雾等一系列的净化操作进入干燥塔。干燥后的炉气用主鼓风机压送至一转一吸或两转两吸制酸装置内制取硫酸。其反应如下: 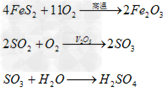
(2)硫磺制酸反应时生成的热传递给进入接触室的需要预热的浓和气体并冷却反应后生成的气体(即热交换过程)熔融硫磺在焚硫炉内用干燥空气燃烧产生SO2气体,经余热锅炉回收燃烧热后进入“一转一吸”或“两转两吸”制酸系统制取硫酸。其反应如下: 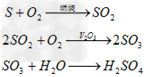
(3)冶炼烟气制酸主要利用有色金属铜、铅、锌、镍、钴等硫化矿在熔炼过程中产生的SO2烟气进行制酸。
其工艺流程除焙烧系统随有色金属硫化矿的焙烧工艺不同而有异外,其制酸工艺与沸腾炉炉气制酸相同。
硫酸的生产流程:
(1)原料工段原料处理能力要满足生产周转,与硫酸生产能力相匹配,能够满足焙烧工艺的进料工况条件结合矿源及工程,应着重考虑如下问题原料的卸车及转运方式、矿库的贮存能力(库容)、干燥及含尘尾气处理、块矿的破碎及筛分等。原料工段设置应尽量少进行固体物料的交叉,流程越简单越好。
(2)焙烧流程焙烧流程一般为:焙烧炉—废热锅炉—旋风除尘器—电除尘器,也可以不设旋风除尘器。这种流程非常紧凑,但电除尘器需专门设计且操作管理要求较高。为了尽可能使工艺技术和设备制造立足国内,增加装置操作的可靠性,使用国内的电除尘器,则倾向于设置旋风除尘器。一般采用增湿输送的干法排渣,有刮板输送机—冷却滚筒(增湿)一带式输送机流程和冷却滚筒+冷却滚筒(增湿)—带式输送机两种流程,目前设计倾向于使用后一种流程。
(3)净化流程大型硫酸装置选择酸洗净化流程。国内大型装置空塔流程居多,即空塔(增湿塔)—填料冷却塔(稀酸板式换热器)一两级电除雾器。近十多年来我国投产的硫铁矿制酸酸洗净化流程绝大多数使用此流程,亦是比较容易掌握的流程。近年来冶炼烟气制酸选择动力波洗涤器代替空塔居多,国内有关专家认为,动力波洗涤器特别适用于烟气量波动比较大的情况,效果较好,但压降较大,对气量均衡稳定的硫铁矿制酸并无明显优势。
(4)干吸流程干吸流程有塔槽一体化流程、三塔一槽流程、三塔两槽流程和三塔三槽流程。塔槽一体化即干燥塔、一吸塔、二吸塔均不设外部泵槽,由各塔的底部分别存液,循环泵设于塔外的管道上,国内比较典型的为贵州瓮福2×400kt/a硫铁矿制酸装置。塔槽一体化省去了泵槽和很多的管线,使得工艺流程简单、设备布置紧凑,有一定的优越性,但在设计时要考虑泵的密封,特别是一吸循环泵。目前,国内设计多采用三塔两槽流程,又以干燥塔一个循环槽.两吸收塔共用一个循环槽居多。干吸塔普遍使用不锈钢槽管式分酸器及大规格填料,可大幅增加分酸点,降低填料高度,优化塔的操作状况,提高塔的操作效率,塔的顶部装设高效除雾器。
(5)转化流程转化工序基本采用两转两吸流程,国内“2+2”,“3+2”,“3+1”几种流程都有,但目前采用较多的是,“3+1”流程,配套换热流程有ⅢⅠ—ⅣⅡ和ⅣⅠ—ⅢⅡ等,设计选择较多的ⅢⅠ—ⅣⅡ根据系统热平衡计算,可以考虑设置热管省煤器。转化系统的流程和设计参数的选择,实际上是系统的优化问题,需与所用催化剂和所用设备情况综合考虑,应尽量提高一转化的转化率,使尾气排放更容易达到日益严格的环保要求。
(6)生产硫酸流程图
1.离子交换膜法电解制碱的主要生产流程可以简单表示如下图所示:

电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙,精制食盐水时经常进行以下措施
(1)过滤海水
(2)加入过量氢氧化钠,去除钙、镁离子,过滤 Ca2++2OH-=Ca(OH)2(微溶) Mg2++2OH-=Mg(OH)2↓
(3)加入过量氯化钡,去除硫酸根离子,过滤 Ba2++SO42-=BaSO4↓
(4)加入过量碳酸钠,去除钙离子、过量钡离子,过滤 Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓
(5)加入适量盐酸,去除过量碳酸根离子 2H++CO32-=CO2↑+H2O
(6)加热驱除二氧化碳
(7)送入离子交换塔,进一步去除钙、镁离子
(8)电解 2NaCl+2H2O
 H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。 2.以氯碱工业为基础的化工生产
NaOH、Cl2和H2都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于各工业。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
由电解槽流出的阴极液中含有30%的NaOH,称为液碱,液碱经蒸发、结晶可以得到固碱。阴极区的另一产物湿氢气经冷却、洗涤、压缩后被送往氢气贮柜。阳极区产物湿氯气经冷却、干燥、净化、压缩后可得到液氯。
2NaOH+Cl2=NaCl+NaClO+H2O H2O+Cl2=HCl+HClO H2+Cl2=2HCl 2NaOH+CO2=Na2CO3(苏打)+H2O NaOH+CO2=NaHCO3(小苏打)
随着人们环境保护意识的增强,对以氯碱工业为基础的化工生产过程中所造成的污染及其产品对环境造成的影响越来越重视。
与“下列说法不正确的是[ ]A.中学化学教材中的三大化工生产:氯碱...”考查相似的试题有:
- 下列实验现象描述正确的是( )A.氯化氢与氨气相遇,有大量的白雾生成B.用铂丝蘸取硫酸钠溶液灼烧,火焰呈黄色C.SO2通入品...
- 二十一世纪被称为海洋世纪,许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是A.氯、溴、碘B...
- 三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程...
- 现有下列高分子化合物,请从各项中选出最 恰当的选项,将代号填入下表中:(1)高分子结构型式示意图:(2)高分子材料的主要性质...
- 废电池伴着生活垃圾将是人类环境的新公害。下列哪种组合中的元素均是废电池中所含的有害元素( )A.Hg、Pb、C、Na B.Cu、K、S...
- 某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):①...
- 下列关于合成材料的说法中,不正确的是[ ]A.塑料、合成纤维和合成橡胶都属于合成材料B.聚氯乙烯可制成薄膜、软管等,其单体是...
- 常用做食品包装材料的是[ ]A.聚氯乙烯B.聚苯乙烯C.酚醛树脂D.聚乙烯
- 化学与科学、技术、社会、环境密切相关,下列做法中不正确的是( )A.泄露在美国墨西哥湾海洋中的大量原油能被海洋生物迅速...
- (三选一)【选修2:化学与技术】以磷肥厂排出的废渣磷石膏为原料制硫酸,同时生产水泥,制得的硫酸又用于生产磷肥。硫酸、磷...