离子方程式:
用实际参加反应的离子符号表示离子反应的式子。
离子方程式书写规则:
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
离子方程式书写及正误的判断方法:
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“
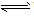
”及状态符号“↑”和“↓”运用是否正确。
强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“
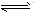
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO
2、SO
2、H
2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
⑩判断电解质在写成离子形式时阴阳离子个数比是否合理。
如Ba(OH)
2溶液和稀H
2SO
4反应的离子方程式往往错误写成:

,正确为:
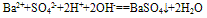
书写与量有关的离子方程式:
基本方法是:把物质的量少的物质的系数定为1,其他物质按最大量消耗。
1.因滴加顺序不同造成连续反应
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
向AlCl3溶液中滴入NaOH溶液至过量,其离子反应分步写 (1)Al3++3OH-==Al(OH)3↓ (2)Al(OH)3+OH-==AlO2-+2H2O
若向NaOH溶液中加入少量AlCl3溶液,其离子反应一步完成 Al3++4OH-==AlO2-+2H2O
若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为: Al3++3OH-==Al(OH)3↓
向AgNO3溶液中滴入稀NH3·H2O至过量,其离子反应分步写(1) Ag++NH3·H2O==AgOH↓+NH4+ (2)AgOH+2NH3·H2O==Ag(NH3)2++OH-+2H2O
若向NH3·H2O溶液中加入少量AgNO3,其离子反应一步完成 Ag++3NH3·H2O==Ag(NH3)2++OH-+NH4++2H2O
若向足量AgNO3溶液中滴入少量NH3·H2O,其离子方程式为:Ag++NH3·H2O==AgOH↓+NH4+
向NaOH溶液中通人CO2气体至过量,其离子反应分步写 (1)2OH-+CO2==CO32-+H2O (2)CO32-+CO2+H2O==2HCO3-
若向足量NaOH溶液中通人少量CO2气体,其离子方程式为: 2OH-+CO2==CO32-+H2O
若向NaOH溶液中通人过量CO2气体,其离子反应一步完成 OH-+CO2==HCO3-
2.过量型:
向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 OH-+Ca2++HCO3-==H2O+CaCO3↓
向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-
Fe与HNO3 :铁过量时:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O
铁不足时:3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
3.定量型:
因还原性I->Fe2+>Br-,所以在FeI2或者FeBr2中通入一定量的Cl2,发生不同的离子反应,依次为:
(1)2I-+Cl2==2Cl-+I2(2)2Fe2++Cl2==2Fe3++2Cl-(3)2Br-+Cl2==2Cl-+Br2
4.目标型
向明矾溶液逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全 Al3++SO42-+Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
向明矾溶液逐滴滴加Ba(OH)2溶液至铝离子刚好沉淀完全 Al3+SO42-+Ba2++3OH-==Al(OH)3↓+2BaSO4↓